题目内容
18.短周期元素中,A元素原子最外层电子数是次外层电子数的2倍;B元素最外层电子数是其内层电子总数3倍;C元素原子M层电子数是K层电子数的3倍;D元素原子最外层有1个电子,D的阳离子与B的阴离子电子层结构相同,则4种元素原子序数关系中正确的是( )| A. | C>D>B>A | B. | D>B>A>C | C. | A>D>C>B | D. | B>A>C>D |
分析 短周期元素中,A元素原子最外层电子数是次外层电子数的2倍,A有2个电子层,最外层电子数为4,则A为碳元素;B元素最外层电子数是其内层电子总数3倍,则B原子有2个电子层,最外层电子数为6,则B为氧元素;C元素原子M层电子数是K层电子数的3倍,有3个电子层,M层电子数为6,故C为S元素;D元素原子最外层有1个电子,处于ⅠA族,D的阳离子与B的阴离子电子层结构相同,则D为Na元素,据此解答.
解答 解:短周期元素中,A元素原子最外层电子数是次外层电子数的2倍,A有2个电子层,最外层电子数为4,则A为碳元素;B元素最外层电子数是其内层电子总数3倍,则B原子有2个电子层,最外层电子数为6,则B为氧元素;C元素原子M层电子数是K层电子数的3倍,有3个电子层,M层电子数为6,故C为S元素;D元素原子最外层有1个电子,处于ⅠA族,D的阳离子与B的阴离子电子层结构相同,则D为Na元素,故原子序数C>D>B>A,
故选A.
点评 本题考查结构与位置关系、核外电子排布等,难度不大,掌握核外电子排布规律是解题关键.

练习册系列答案
相关题目
8.某恒容密闭容器中充入一定量SO2和O2进行反应:2SO2(g)+O2(g)?2SO3(g)△H<0,反应速率(v)与温度(T)、SO2的体积分数[V(SO2)%]与压强(p)的关系分别如图甲、图乙所示.下列说法正确的是( )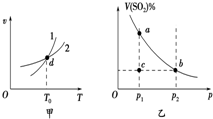

| A. | 图甲中,曲线1表示正反应速率和温度的关系,曲线2表示逆反应速率与温度的关系 | |
| B. | 图乙中,温度恒定时,a、b两点对应的反应速率:va>vb | |
| C. | 图甲中,d点表示温度为T0时,反应已经达到平衡 | |
| D. | 图乙中,温度恒定时,c点的反应正在向正反应方向进行 |
9.下列叙述符合平衡移动原理的是( )
| A. | 向FeCl3+3KSCN?Fe(SCN)3+3KCl平衡体系中,加入KCl固体,溶液颜色加深 | |
| B. | 对2NO2?N2O4的平衡体系增大压强,平衡后气体颜色变浅 | |
| C. | 对H2(g)+I2(g)?2HI(g)的平衡体系增大压强,容器内气体颜色变深 | |
| D. | 向滴有石蕊的醋酸溶液中通入HCl气体,溶液颜色加深 |
6.爱迪生电池在充电和放电时发生的反应:Fe+NiO2+2H2O?Fe(OH)2+Ni(OH)2,下列该蓄电池推断不正确的是( )
| A. | 放电时,Fe参与负极反应,NiO2参与正极反应 | |
| B. | 充电时,阴极上的电极反应式为:Fe(OH)2+2e-═Fe+2OH- | |
| C. | 蓄电池的电极必须浸入某种碱性电解质溶液中 | |
| D. | 放电时,电解质溶液中的阴离子向正极方向移动 |
10.以下实验能获得成功的是( )
| A. | 在蔗糖水解(用稀H2SO4作催化剂)后的溶液中直接加少量新制Cu(OH)2加热有砖红色沉淀产生 | |
| B. | 将铁屑、溴水、苯混合制溴苯 | |
| C. | 在苯中滴入浓硝酸制硝基苯 | |
| D. | 将铜丝在酒精灯加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 |
7.下列各组物质中,互称为同素异形体的是( )
| A. | ${\;}_{6}^{12}$C和${\;}_{6}^{13}$C | B. | 金刚石和石墨 | ||
| C. | CH3CH=CH2和环丙烷 | D. | 丁烷和异丁烷 |
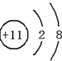 .
.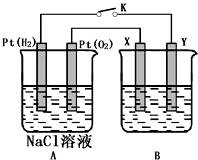 某化学兴趣小组用如图所示装置进行电化学原理的实验探究,试回答下列问题:
某化学兴趣小组用如图所示装置进行电化学原理的实验探究,试回答下列问题: