题目内容
X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g/L;W的质子数是X、Y、Z、M四种元素质子数之和的
.下列说法正确的是( )
| 1 |
| 2 |
| A、原子半径:W>Z>Y>X>M |
| B、XZ2、M2Z2、W2Z2均为含非极性键的共价化合物 |
| C、由X元素形成的单质有的可以导电 |
| D、由X、Y、Z、M四种元素形成的化合物中不可能含有离子键 |
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:由题给的条件可知,X、Y、Z、M、W这五种短周期元素的排列,不是按原子序数依次递增排列的,其中只有X、Y、Z三种元素是原子序数依次递增的同周期元素,由X、Y、Z的最外层电子数之和为15,最外层电子数平均为5,X与Z可形成XZ2气态分子,X为+4价,Y为-2价,可推出X、Y、Z分别为C、N、O三种元素;根据Y与M形成的气态化合物在标准状况下的密度0.76g?L-1,就可计算出该气态化合物的摩尔质量为22.4L/mol×0.76g?L-1=17g/mol,从而确定M为H元素;根据W的质子数是X、Y、Z、M四种元素质子数之和的
,推出W的质子数为
×(6+7+8+1)=11,所以W为Na元素,据此答题.
| 1 |
| 2 |
| 1 |
| 2 |
解答:
解:由题给的条件可知,X、Y、Z、M、W这五种短周期元素的排列,不是按原子序数依次递增排列的,其中只有X、Y、Z三种元素是原子序数依次递增的同周期元素,由X、Y、Z的最外层电子数之和为15,最外层电子数平均为5,X与Z可形成XZ2气态分子,X为+4价,Y为-2价,可推出X、Y、Z分别为C、N、O三种元素;根据Y与M形成的气态化合物在标准状况下的密度0.76g?L-1,就可计算出该气态化合物的摩尔质量为22.4L/mol×0.76g?L-1=17g/mol,从而确定M为H元素;根据W的质子数是X、Y、Z、M四种元素质子数之和的
,推出W的质子数为
×(6+7+8+1)=11,所以W为Na元素,
A.同周期自左向右原子半径减小,同主族自上到下原子半径增大,故原子半径Na>C>N>O>H,即W>X>Y>Z>M,故A错误;
B.W2Z2为过氧化钠,为离子化合物,故B错误;
C.X为C,形成的单质由金刚石、石墨、C60等,其中石墨能导电,故C正确;
D.由X、Y、Z、M四种元素形成的化合物可为氨碳酸铵、醋酸铵等物质,都含有离子键,故D错误.
故选C.
| 1 |
| 2 |
| 1 |
| 2 |
A.同周期自左向右原子半径减小,同主族自上到下原子半径增大,故原子半径Na>C>N>O>H,即W>X>Y>Z>M,故A错误;
B.W2Z2为过氧化钠,为离子化合物,故B错误;
C.X为C,形成的单质由金刚石、石墨、C60等,其中石墨能导电,故C正确;
D.由X、Y、Z、M四种元素形成的化合物可为氨碳酸铵、醋酸铵等物质,都含有离子键,故D错误.
故选C.
点评:本题考查元素推断、元素周期律、分子结构及C、N、Na元素化合物性质等,难度中等,元素推断是解题的关键.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
在反应H2S+H2SO4═S↓+SO2↑+2H2O中,若有32g硫生成,则转移电子为( )
| A、6 mol |
| B、3 mol |
| C、2 mol |
| D、4 mol |
在100mL某混合溶液中,c(HNO3)=0.2mol?L-1,c(H2SO4)=0.1mol?L-1,向其中加入1.92g Cu粉,微热充分反应后溶液中的c(Cu2+)为( )
| A、0.15 mol?L-1 |
| B、0.3 mol?L-1 |
| C、0.225 mol?L-1 |
| D、无法计算 |
下列物质按纯净物、混合物、电解质、非电解质的顺序组合的一组为( )
| A、蒸馏水、氨水、氢氧化钡、二氧化硫 |
| B、纯盐酸、空气、硫酸、干冰 |
| C、胆矾、盐酸、铁、碳酸钙 |
| D、氧化钙、漂白粉、氧化铝、碳酸钠 |
钾长石的主要成分为硅酸盐,由前20号元素中的四种组成,化学式为XYZ3W8,其中只有W显负价.X、Y的最外层电子数之和与Z的最高正价数相等,Y3+与W的阴离子具有相同的电子层结构,X、W的质子数之和等于Y、Z的质子数之和.下列说法错误的是( )
| A、X的离子半径>Y的离子半径 |
| B、Z的氢化物稳定性>W的氢化物稳定性 |
| C、化合物X2W2和Y2W3中都不含配位键 |
| D、1mol ZW2晶体所含Z-W键的数目为4NA |
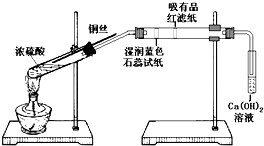 某同学利用如图装置进行浓硫酸和铜反应并验证二氧化硫的性质.按如图实验装置连接仪器和放置药品.加热浓硫酸约1分钟后撤去酒精灯,将铜丝插入液面,反应一段时间后拔出.实验结束后会看到两个试管的液体底部均有少量的白色固体.下列对该实验的现象分析或推断正确的是( )
某同学利用如图装置进行浓硫酸和铜反应并验证二氧化硫的性质.按如图实验装置连接仪器和放置药品.加热浓硫酸约1分钟后撤去酒精灯,将铜丝插入液面,反应一段时间后拔出.实验结束后会看到两个试管的液体底部均有少量的白色固体.下列对该实验的现象分析或推断正确的是( )| A、湿润的蓝色石蕊试纸先变红后褪色 |
| B、左边试管出现的白色固体是由于浓硫酸的脱水性所致 |
| C、从该实验的描述中可以体会出铜与浓硫酸的反应是一个放热反应 |
| D、本实验体现出了二氧化硫的酸性、漂白性和弱氧化性 |
0.1mol某金属单质与足量的盐酸反应,放出1.12L H2(标准状况),并转变为具有Ar原子的电子层结构的离子,该金属元素在元素周期表中的位置是( )
| A、第三周期第IA族 |
| B、第四周期第IA族 |
| C、第三周期第ⅡA族 |
| D、第四周期第ⅡA族 |
 如图是某学校实验室从化学试剂商店买回来的氢氧化钠试剂标签上的部分内容.某同学从该试剂瓶中取出24.0g固体,配成500mL溶液,请计算
如图是某学校实验室从化学试剂商店买回来的氢氧化钠试剂标签上的部分内容.某同学从该试剂瓶中取出24.0g固体,配成500mL溶液,请计算 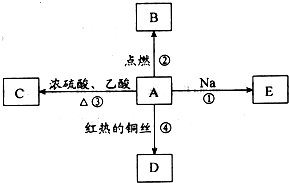 ⅠA是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种反应.
ⅠA是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种反应.