题目内容
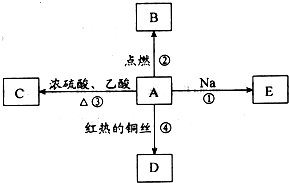 ⅠA是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种反应.
ⅠA是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种反应.(1)A的结构简式:
(2)写出下列反应的化学方程式并指出反应类型:
反应①:
反应②:
反应③:
反应④:
(3)写出由乙烯制取A的化学方程式并指出反应类型
Ⅱ(4分) 某有机物12g完全燃烧,生成7.2gH2O和8.96LCO2(标准状况下),0.5mol此有机物的质量为30g.该有机物的分子式为
考点:有机物的推断
专题:有机物的化学性质及推断
分析:I.A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,能与红热的铜丝反应得到D,能与Na反应,能与乙酸反应,A含有羟基,故A为CH3CH2OH,则C为CH3COOCH2CH3,D为CH3CHO,CH3CH2OH燃烧生成二氧化碳与水,CH3CH2OH与Na反应生成CH3CH2ONa与氢气,据此解答;
II.计算12g有机物中含有碳元素、氢元素物质的量及质量,根据守恒定律确定是否含有元素,若含有氧元素,计算氧元素物质的量,进而计算有机物最简式,结合相对分子质量确定有机物分子式,再结合有机物能与金属钠反应,也能与碱溶液反应,判断分子中官能团书写可能的结构简式.
II.计算12g有机物中含有碳元素、氢元素物质的量及质量,根据守恒定律确定是否含有元素,若含有氧元素,计算氧元素物质的量,进而计算有机物最简式,结合相对分子质量确定有机物分子式,再结合有机物能与金属钠反应,也能与碱溶液反应,判断分子中官能团书写可能的结构简式.
解答:
解:I.A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,能与红热的铜丝反应得到D,能与Na反应,能与乙酸反应,A含有羟基,故A为CH3CH2OH,则C为CH3COOCH2CH3,D为CH3CHO,CH3CH2OH燃烧生成二氧化碳与水,CH3CH2OH与Na反应生成CH3CH2ONa与氢气,
(1)A为乙醇,结构简式为CH3CH2OH,D为乙醛,含有官能团为醛基,故答案为:CH3CH2OH;醛基;
为乙酸乙酯 (CH3COOCH2CH3),
(2)反应①为2CH3CH2OH+2Na→2CH3CH2ONa+H2↑;
反应②为CH3CH2OH+3O2
2CO2+3H2O;
反应③为CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O,属于酯化反应;
反应④为2CH3CH2OH+O2
2CH3CHO+2H2O,属于氧化反应,
故答案为:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑;CH3CH2OH+3O2
2CO2+3H2O;
CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O,酯化反应;2CH3CH2OH+O2
2CH3CHO+2H2O,氧化反应;
(3)由乙烯制取乙醇的化学方程式为:CH2=CH2+H2O
CH3CH2OH,属于加成反应,
故答案为:CH2=CH2+H2O
CH3CH2OH,加成反应;
II.该有机物的摩尔质量为
=60g/mol,7.2gH2O中H原子的物质的量为
×2=0.8mol,标况下8.96LCO2的物质的量为
=0.4mol,则n(C)=0.4mol,
12g有机物中m(C)+m(H)=0.4mol×12g/mol+0.8mol×1g/mol=5.6g,故12g有机物中m(O)=12g-5.6g=6.4g,则n(O)=
=0.4mol,
所以n(C):n(H):n(O)=0.4mol:0.8mol:0.4mol=1:2:1,该有机物的最简式为CH2O,分子式为(CH2O)n,又因相对分子质量为60,即30n=60,解得n=2,所以该有机物的分子式为:C2H4O2,有机物具有弱酸性,能与金属钠反应,也能与碱溶液反应,所以只能是酸,结构简式为CH3COOH,故答案为:C2H4O2;CH3COOH.
(1)A为乙醇,结构简式为CH3CH2OH,D为乙醛,含有官能团为醛基,故答案为:CH3CH2OH;醛基;
为乙酸乙酯 (CH3COOCH2CH3),
(2)反应①为2CH3CH2OH+2Na→2CH3CH2ONa+H2↑;
反应②为CH3CH2OH+3O2
| 点燃 |
反应③为CH3COOH+CH3CH2OH
| 浓硫酸 |
| △ |
反应④为2CH3CH2OH+O2
| Cu |
| △ |
故答案为:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑;CH3CH2OH+3O2
| 点燃 |
CH3COOH+CH3CH2OH
| 浓硫酸 |
| Cu |
| △ |
(3)由乙烯制取乙醇的化学方程式为:CH2=CH2+H2O
| 催化剂 |
故答案为:CH2=CH2+H2O
| 催化剂 |
II.该有机物的摩尔质量为
| 3g |
| 0.5mol |
| 7.2g |
| 18g/mol |
| 8.96L |
| 22.4L/mol |
12g有机物中m(C)+m(H)=0.4mol×12g/mol+0.8mol×1g/mol=5.6g,故12g有机物中m(O)=12g-5.6g=6.4g,则n(O)=
| 6.4g |
| 16g/mol |
所以n(C):n(H):n(O)=0.4mol:0.8mol:0.4mol=1:2:1,该有机物的最简式为CH2O,分子式为(CH2O)n,又因相对分子质量为60,即30n=60,解得n=2,所以该有机物的分子式为:C2H4O2,有机物具有弱酸性,能与金属钠反应,也能与碱溶液反应,所以只能是酸,结构简式为CH3COOH,故答案为:C2H4O2;CH3COOH.
点评:本题考查有机物的推断、有机物分子式的确定等,属于拼合型题目,I中A为乙醇为推断的突破口,侧重常见有机物性质的考查,II中关键是计算有机物分子式,注意对基础知识的理解掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列图式表示正确的是( )
A、二氧化碳 |
| B、次氯酸的结构式 H-Cl-O |
| C、铁离子的价电子排布式 3d34s2 |
D、氯化铯的晶体结构  |
X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g/L;W的质子数是X、Y、Z、M四种元素质子数之和的
.下列说法正确的是( )
| 1 |
| 2 |
| A、原子半径:W>Z>Y>X>M |
| B、XZ2、M2Z2、W2Z2均为含非极性键的共价化合物 |
| C、由X元素形成的单质有的可以导电 |
| D、由X、Y、Z、M四种元素形成的化合物中不可能含有离子键 |
X、Y是周期表前二十号元素,已知X、Y之间原子序数相差3,X、Y能形成化合物M.下列说法正确的是( )
| A、若X、Y处于同一周期,则化合物M不可能是正四面体型分子晶体 |
| B、若X的单质常温下是气体,则Y的单质常温下也是气体 |
| C、若X、Y两元素周期数差1,则属于离子化合物的M只有四种 |
| D、若M属于离子晶体,则其中可能含有非极性键 |
关于Ca(钙)元素的叙述正确的是( )
| A、位于元素周期表中短周期 |
| B、原子最外层有1个电子 |
| C、属于金属元素,和Na同属于ⅠA族 |
| D、能和水反应,生成氢气 |
化学概念在逻辑上存在如图关系,对下列概念的说法正确的是( )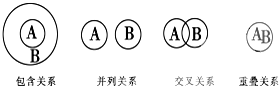

| A、化合物与电解质属于包含关系 |
| B、单质与非电解质属于包含关系 |
| C、溶液与分散系属于并列关系 |
| D、化合物与碱性氧化物属于交叉关系 |
