题目内容
0.1mol某金属单质与足量的盐酸反应,放出1.12L H2(标准状况),并转变为具有Ar原子的电子层结构的离子,该金属元素在元素周期表中的位置是( )
| A、第三周期第IA族 |
| B、第四周期第IA族 |
| C、第三周期第ⅡA族 |
| D、第四周期第ⅡA族 |
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:金属与酸反应置换出氢气,金属提供电子,根据氧化还原反应电子转移守恒,计算金属原子失去的电子数.结合金属原子失去形成具有Ar原子的电子层结构的离子,确定金属元素的质子数,进而确定金属元素在元素周期表中的位置.
解答:
解:氢气的物质的量为
=0.05mol;
令金属原子失去的电子数为n,根据电子转移守恒有:
0.1mol×n=0.05mol×2,解得n=1,
即金属原子失去1个电子形成金属离子,由于金属原子失去1个电子,形成具有Ar原子的电子层结构的离子.
所以+1价金属离子核外有18个电子,故该金属元素质子数为18+1=19,
即该金属为K元素,位于周期表第四周期第ⅠA族.
故选B.
| 1.12L |
| 22.4L/mol |
令金属原子失去的电子数为n,根据电子转移守恒有:
0.1mol×n=0.05mol×2,解得n=1,
即金属原子失去1个电子形成金属离子,由于金属原子失去1个电子,形成具有Ar原子的电子层结构的离子.
所以+1价金属离子核外有18个电子,故该金属元素质子数为18+1=19,
即该金属为K元素,位于周期表第四周期第ⅠA族.
故选B.
点评:考查通过计算推断元素,难度中等,注意从氧化剂、还原剂得失电子的数目关系判断金属元素原子失去电子数目是解题的关键.

练习册系列答案
相关题目
X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g/L;W的质子数是X、Y、Z、M四种元素质子数之和的
.下列说法正确的是( )
| 1 |
| 2 |
| A、原子半径:W>Z>Y>X>M |
| B、XZ2、M2Z2、W2Z2均为含非极性键的共价化合物 |
| C、由X元素形成的单质有的可以导电 |
| D、由X、Y、Z、M四种元素形成的化合物中不可能含有离子键 |
下列对有机物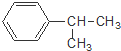 的叙述中,不正确的是( )
的叙述中,不正确的是( )
 的叙述中,不正确的是( )
的叙述中,不正确的是( )| A、它难溶于水,但易溶于苯. |
| B、它会使酸性高锰酸钾溶液褪色 |
| C、与Br2发生取代反应可生成三种一溴代物 |
| D、一定温度下可以和浓硝酸、浓硫酸的混合物发生硝化反应 |
化学概念在逻辑上存在如图关系,对下列概念的说法正确的是( )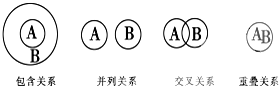

| A、化合物与电解质属于包含关系 |
| B、单质与非电解质属于包含关系 |
| C、溶液与分散系属于并列关系 |
| D、化合物与碱性氧化物属于交叉关系 |
关于△H的说法不正确的是( )
| A、反应的△H 由生成物与反应物的焓值差决定 |
| B、反应在恒压条件下的热效应为焓变 |
| C、某些反应的△H 可以通过实验测得 |
| D、放热反应的焓变取正值 |