题目内容
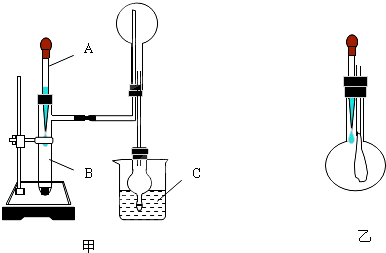
某兴趣小组用如图装置探究氨的催化氧化.
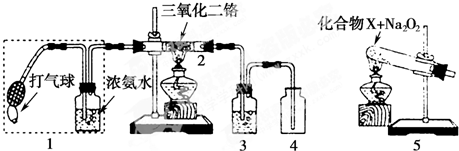
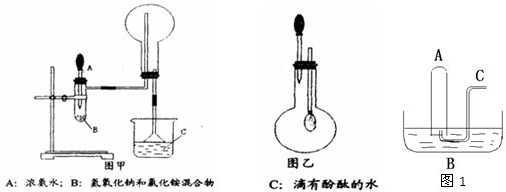
(1)写出实验室制NH3的化学方程式 ,还可以用 (填试剂名称)制备NH3.
(2)氨催化氧化的化学方程式为 .
(3)加热玻璃管2一段时间后,挤压1中打气球鼓入空气,观察到2中物质呈红热状态;停止加热后仍能保持红热,该反应是 反应(填“吸热”或“放热”).
(4)为保证在装置4中观察到红棕色气体,装置3应装入 ;若取消3,在4中仅观察到大量白烟,原因是 .
(5)为实现氨的催化氧化,也可用装置5替换装置 (填装置代号);化合物X为 (只写一种),Na2O2的作用是 .

(1)写出实验室制NH3的化学方程式
(2)氨催化氧化的化学方程式为
(3)加热玻璃管2一段时间后,挤压1中打气球鼓入空气,观察到2中物质呈红热状态;停止加热后仍能保持红热,该反应是
(4)为保证在装置4中观察到红棕色气体,装置3应装入
(5)为实现氨的催化氧化,也可用装置5替换装置
考点:氨的制取和性质
专题:实验题
分析:(1)实验室用固体氯化铵和熟石灰粉末混合加热制取氨气;用浓氨水与NaOH固体或生石灰或碱石灰等混合可以迅速制备少量氨气;
(2)氨气具有还原性,在催化剂作用下可与氧气反应被氧化为NO;
(3)根据反应现象判断,停止加热后仍能保持红热,即可说明该反应放热;
(4)红棕色气体为NO2,易与水反应,应干燥,如不干燥,NO2与水反应生成硝酸,进而与氨气生成硝酸铵;
(5)装置1能提供氨气和氧气,装置5也能提供氨气和氧气,但装置5中应加入氯化铵和过氧化钠,可生成氨气和氧气.
(2)氨气具有还原性,在催化剂作用下可与氧气反应被氧化为NO;
(3)根据反应现象判断,停止加热后仍能保持红热,即可说明该反应放热;
(4)红棕色气体为NO2,易与水反应,应干燥,如不干燥,NO2与水反应生成硝酸,进而与氨气生成硝酸铵;
(5)装置1能提供氨气和氧气,装置5也能提供氨气和氧气,但装置5中应加入氯化铵和过氧化钠,可生成氨气和氧气.
解答:
解:(1)实验室用氯化铵和消石灰反应生成氨气和氯化钙、水,反应的化学方程式为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;
用浓氨水与NaOH固体或生石灰或碱石灰等混合可以迅速制备少量氨气,
故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;浓氨水和NaOH固体(或生石灰或碱石灰等);
(2)氨气具有还原性,在催化剂作用下可与氧气反应被氧化为NO,反应方程式为:4NH3+5O2
4NO+6H2O,
故答案为:4NH3+5O2
4NO+6H2O;
(3)停止加热后仍能保持红热,即可说明该反应放热,故答案为:放热;
(4)NO2易与水反应,应干燥,如不干燥,NO2与水反应生成硝酸而观察不到颜色,NO2与水反应生成HNO3,NH3与HNO3反应生成了NH4NO3,可观察到白烟生成,
故答案为:浓H2SO4;生成的NO与O2反应生成NO2,NO2与水反应生成HNO3,NH3与HNO3反应生成了NH4NO3;
(5)装置1能提供氨气和氧气,装置5也能提供氨气和氧气,但装置5中应加入氯化铵和过氧化钠,可生成氨气和氧气,反应为:NH4Cl
HCl+NH3,2HCl+Na2O2═2NaCl+O2+H2O.
故答案为:1; NH4Cl;与HCl反应生成氧气.
| ||
用浓氨水与NaOH固体或生石灰或碱石灰等混合可以迅速制备少量氨气,
故答案为:2NH4Cl+Ca(OH)2
| ||
(2)氨气具有还原性,在催化剂作用下可与氧气反应被氧化为NO,反应方程式为:4NH3+5O2
| ||
| △ |
故答案为:4NH3+5O2
| ||
| △ |
(3)停止加热后仍能保持红热,即可说明该反应放热,故答案为:放热;
(4)NO2易与水反应,应干燥,如不干燥,NO2与水反应生成硝酸而观察不到颜色,NO2与水反应生成HNO3,NH3与HNO3反应生成了NH4NO3,可观察到白烟生成,
故答案为:浓H2SO4;生成的NO与O2反应生成NO2,NO2与水反应生成HNO3,NH3与HNO3反应生成了NH4NO3;
(5)装置1能提供氨气和氧气,装置5也能提供氨气和氧气,但装置5中应加入氯化铵和过氧化钠,可生成氨气和氧气,反应为:NH4Cl
| ||
故答案为:1; NH4Cl;与HCl反应生成氧气.
点评:本题考查氨气的制取原理、反应装置及化学性质,题目较为综合,涉及氨气的制取、性质以及二氧化氮和硝酸铵等知识,注意把握元素化合物知识的理解和应用.

练习册系列答案
相关题目
已知反应:①A2+2B-=2A-+B2②B2+2C-=2B-+C2③C2+2D-=2C-+D2,则A-、B-、C-、D-还原性的正确顺序是( )
| A、A->B->C->D- |
| B、D->C->B->A- |
| C、A->D->B->C- |
| D、D->B->A->C- |
现将1mo1Cu2S与144克FeO投入到足量稀硝酸溶液中,充分反应得到Fe(NO3)3、Cu(NO3)2、CuSO4的混合溶液,并产生NO气体.则最终消耗的硝酸的物质的量是( )
| A、12 mo1 |
| B、15 mo1 |
| C、16 mo1 |
| D、17 mo1 |
 对硝基苯甲酸在医药、感光材料等工业中应用广泛.以对硝基甲苯等为原料制取对硝基苯甲酸(黄色结晶,熔点242℃,沸点约359℃,微溶于水,能升华.)的反应原理为:
对硝基苯甲酸在医药、感光材料等工业中应用广泛.以对硝基甲苯等为原料制取对硝基苯甲酸(黄色结晶,熔点242℃,沸点约359℃,微溶于水,能升华.)的反应原理为: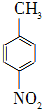 +Na2Cr2O7+4H2SO4→
+Na2Cr2O7+4H2SO4→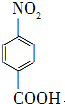 +Na2SO4+Cr2(SO4)3+5H2O
+Na2SO4+Cr2(SO4)3+5H2O 制取氨气并完成喷泉实验(图中夹持装置均已略去).
制取氨气并完成喷泉实验(图中夹持装置均已略去).