题目内容
3.NA表示阿伏加德罗常数的值,下列叙述中正确的是( )| A. | 100g98%的浓硫酸中含有的氢原子数目为2NA | |
| B. | 30g乙酸中含有的碳氢键数目为2NA | |
| C. | 16g16O2中含有的质子数目为10NA | |
| D. | 1mol苯完全转化为环己烷,转移的电子数目为6NA |
分析 A、硫酸溶液中,除了硫酸外,水也含H原子;
B、求出乙酸的物质的量,然后根据乙酸中含3条C-H键来分析;
C、16O2由16O原子构成;
D、1mol苯转化为环己烷消耗3mol氢气.
解答 解:A、硫酸溶液中,除了硫酸外,水也含H原子,故溶液中的氢原子的个数多于2NA个,故A错误;
B、30g乙酸的物质的量为0.5mol,而乙酸中含3条C-H键,故0.5mol乙酸中含NA条C-H键,故B错误;
C、16O2由16O原子构成,故16g16O2中含有的16O的物质的量为1mol,个数为NA个,而1个16O中含8个质子,故共含质子8NA个,故C错误;
D、1mol苯转化为环己烷消耗3mol氢气,而氢气反应后变为+1价,故1mol苯转移6mol电子即6NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
相关题目
14.设NA为阿伏伽德罗常数的值,下列说法中正确的是( )
| A. | 标准状况下,22.4L氧气反应时特移电子数为2NA | |
| B. | 1molCnH2n+2(n≥2)中含有的C-C键数为(n-1)NA | |
| C. | 0.1mol24Mg32S晶体中所含中子总数为28NA | |
| D. | 标准状况下,11.2LSO3所含的分子数目为0.5NA |
11.0.9g某元素的单质与氯气反应后,质量增加3.55g,则这种元素是( )
| A. | P | B. | Mg | C. | Al | D. | Fe |
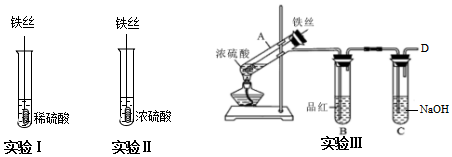
8.下列装置应用于实验室制NO并回收硝酸铜的实验,能达到实验目的是( )
| A. | 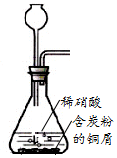 用装置制取NO | |
| B. |  用装置收集NO | |
| C. | 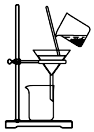 用装置分离炭粉和硝酸铜溶液 | |
| D. | 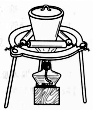 用装置蒸干硝酸铜溶液制Cu(NO3)2•3H2O |
15.化合物F是一种医药中间体,其结构简式如图所示,下列有关F的说法正确的是( )
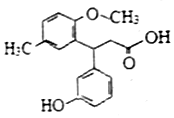

| A. | 所有碳原子可以共平面 | B. | 分子中有1个手性碳原子 | ||
| C. | 能与Na2CO3溶液反应 | D. | 能发生加成、取代、消去反应 |
 A、B、C、D、E分别是铁或铁的化合物,其中D是一种红褐色沉淀,其相互反应关系如图所示:
A、B、C、D、E分别是铁或铁的化合物,其中D是一种红褐色沉淀,其相互反应关系如图所示: