题目内容
11.0.9g某元素的单质与氯气反应后,质量增加3.55g,则这种元素是( )| A. | P | B. | Mg | C. | Al | D. | Fe |
分析 根据质量守恒可知,增加的3.55g为参加反应的氯气的质量,其物质的量为0.05mol,根据电子转移守恒可知,0.9g单质反应时提供0.1mol电子,故提供1mol电子时单质的质量为9g,结合选项计算判断.
解答 解:根据质量守恒可知,增加的3.55g为参加反应的氯气的质量,其物质的量为0.05mol,根据电子转移守恒可知,0.9g单质反应时提供0.1mol电子,故提供1mol电子时单质的质量为9g,
A.提供1mol电子需要P的质量为$\frac{31}{3}$g或$\frac{31}{5}$g,故A不符合;
B.提供1mol电子需要Mg0.5mol,其质量为24g/mol×0.5mol=12g,故B不符合;
C.提供1mol电子需要Al的质量为$\frac{1mol}{3}$×27g/mol=9g,
D.反应在Fe表现+3价,提供1mol电子需要Fe的质量为$\frac{1mol}{3}$×56g/mol=18.7g,故D不符合;
故选C.
点评 本题考查了化学方程式的计算,题目难度不大,明确发生反应实质为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
1.缩小容器容积,增大压强,下列反应所建立的平衡向左移动的是( )
| A. | 2NO2(g)?N2O4 | B. | N2(g)+3H2(g)?2NH3(g) | C. | C(s)+O2(g)?2CO(g) | D. | H2(g)+I2(g)?2HI(g) |
2.下列反应可以一步完成的是( )
| A. | Fe→Fe(OH)2→Fe(OH)3 | B. | Cl2→HClO→HCl | C. | S→SO3→H2SO4 | D. | Si→SiO2→H2SiO3 |
19.元素X、Y、Z、W、Q、M在元素周期表中的相对位置如图所示,其中Z元素是目前发现的非金属性最强的元素,下列说法正确的是( )
| X | Y | Z | |
| W | Q | M |
| A. | 对应氢化物的沸点:Y>Q,Z>M | |
| B. | XM4的比例模型为 ,其二氢取代物有两种 ,其二氢取代物有两种 | |
| C. | W的氧化物能在常温下与Z、M的氢化物反应 | |
| D. | Y、Z的单质能分别将Q、M从它们氢化物的水溶液中置换出来 |
6.化学与生活密切相关,下列说法中正确的是( )
| A. | 淀粉、纤维素和油脂都属于天然高分子化合物 | |
| B. | 合成纤维和光导纤维都是新型有机非金属材料 | |
| C. | “玉不琢不成器”、“百炼方能成钢”发生的均为化学变化 | |
| D. | “火树银花”中的焰火实质上是金属元素的焰色反应 |
16.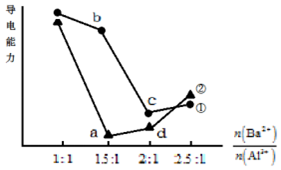 向两份20mL 0.1mol/L Ba(OH)2溶液中各加入一定量的KAl(SO4)2和Al2(SO4)3,溶液的导电性随$\frac{n(B{a}^{2+})}{n(A{l}^{3+})}$(混合前)的变化关系如右图所示.下列分析不正确的是( )
向两份20mL 0.1mol/L Ba(OH)2溶液中各加入一定量的KAl(SO4)2和Al2(SO4)3,溶液的导电性随$\frac{n(B{a}^{2+})}{n(A{l}^{3+})}$(混合前)的变化关系如右图所示.下列分析不正确的是( )
 向两份20mL 0.1mol/L Ba(OH)2溶液中各加入一定量的KAl(SO4)2和Al2(SO4)3,溶液的导电性随$\frac{n(B{a}^{2+})}{n(A{l}^{3+})}$(混合前)的变化关系如右图所示.下列分析不正确的是( )
向两份20mL 0.1mol/L Ba(OH)2溶液中各加入一定量的KAl(SO4)2和Al2(SO4)3,溶液的导电性随$\frac{n(B{a}^{2+})}{n(A{l}^{3+})}$(混合前)的变化关系如右图所示.下列分析不正确的是( )| A. | ①代表加入KAl(SO4)2的变化曲线 | |
| B. | a点溶液的pH值约为7 | |
| C. | b点溶液中大量存在的阳离子有Al3+和Ba2+ | |
| D. | c、d两点溶液中Ba(OH)2均已完全反应 |
3.NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 100g98%的浓硫酸中含有的氢原子数目为2NA | |
| B. | 30g乙酸中含有的碳氢键数目为2NA | |
| C. | 16g16O2中含有的质子数目为10NA | |
| D. | 1mol苯完全转化为环己烷,转移的电子数目为6NA |
3.下列反应的离子方程式中正确的是( )
| A. | 铁与盐酸的反应:2Fe+6H+=2Fe3++3H2↑ | |
| B. | 石灰石与稀盐酸反应制备二氧化碳:CO32-+2H+=H2O+CO2↑ | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+=Cu2++Ag | |
| D. | 硫酸铜溶液和氢氧化钡溶液混合:Cu2++SO42-+Ba2++2OH-=Cu(OH)2↓+BaSO4↓ |