题目内容
8.下列装置应用于实验室制NO并回收硝酸铜的实验,能达到实验目的是( )| A. | 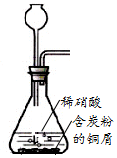 用装置制取NO | |
| B. |  用装置收集NO | |
| C. | 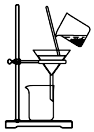 用装置分离炭粉和硝酸铜溶液 | |
| D. | 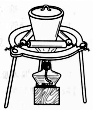 用装置蒸干硝酸铜溶液制Cu(NO3)2•3H2O |
分析 A.生成的NO易从长颈漏斗逸出;
B.NO与氧气反应,不能使用排空气法收集;
C.炭粉不溶于水,和硝酸铜溶液的分离方法为过滤;
D.水解生成硝酸易挥发.
解答 解:A.生成的NO易从长颈漏斗逸出,应选分液漏斗,故A错误;
B.NO与氧气反应,不能使用排空气法收集,应选排水法收集,故B错误;
C.炭粉不溶于水,和硝酸铜溶液的分离方法为过滤,则图中过滤装置可分离,故C正确;
D.水解生成硝酸易挥发,不能利用坩埚蒸发,应选蒸发皿、冷却结晶制备晶体,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应、混合物分离提纯、盐类水解及实验技能为解本题关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.有关下列图象的分析正确的是( )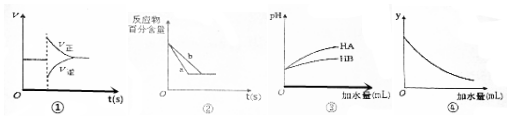

| A. | 图①表示在N2(g)+3H2(g)?2NH3(g)达到平衡后,减少NH3浓度时速率的变化 | |
| B. | 图②中a、b曲线分别表示反应H2(g)+I2(g)?2HI(g)在有催化剂和无催化剂存在下建立平衡的过程 | |
| C. | 图③说明HB是比HA更弱的酸 | |
| D. | 图④中的y表示将冰醋酸加水稀释时溶液导电能力的变化情况 |
19.元素X、Y、Z、W、Q、M在元素周期表中的相对位置如图所示,其中Z元素是目前发现的非金属性最强的元素,下列说法正确的是( )
| X | Y | Z | |
| W | Q | M |
| A. | 对应氢化物的沸点:Y>Q,Z>M | |
| B. | XM4的比例模型为 ,其二氢取代物有两种 ,其二氢取代物有两种 | |
| C. | W的氧化物能在常温下与Z、M的氢化物反应 | |
| D. | Y、Z的单质能分别将Q、M从它们氢化物的水溶液中置换出来 |
16.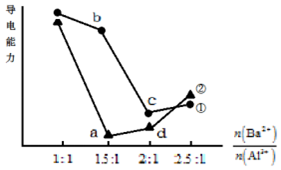 向两份20mL 0.1mol/L Ba(OH)2溶液中各加入一定量的KAl(SO4)2和Al2(SO4)3,溶液的导电性随$\frac{n(B{a}^{2+})}{n(A{l}^{3+})}$(混合前)的变化关系如右图所示.下列分析不正确的是( )
向两份20mL 0.1mol/L Ba(OH)2溶液中各加入一定量的KAl(SO4)2和Al2(SO4)3,溶液的导电性随$\frac{n(B{a}^{2+})}{n(A{l}^{3+})}$(混合前)的变化关系如右图所示.下列分析不正确的是( )
 向两份20mL 0.1mol/L Ba(OH)2溶液中各加入一定量的KAl(SO4)2和Al2(SO4)3,溶液的导电性随$\frac{n(B{a}^{2+})}{n(A{l}^{3+})}$(混合前)的变化关系如右图所示.下列分析不正确的是( )
向两份20mL 0.1mol/L Ba(OH)2溶液中各加入一定量的KAl(SO4)2和Al2(SO4)3,溶液的导电性随$\frac{n(B{a}^{2+})}{n(A{l}^{3+})}$(混合前)的变化关系如右图所示.下列分析不正确的是( )| A. | ①代表加入KAl(SO4)2的变化曲线 | |
| B. | a点溶液的pH值约为7 | |
| C. | b点溶液中大量存在的阳离子有Al3+和Ba2+ | |
| D. | c、d两点溶液中Ba(OH)2均已完全反应 |
3.NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 100g98%的浓硫酸中含有的氢原子数目为2NA | |
| B. | 30g乙酸中含有的碳氢键数目为2NA | |
| C. | 16g16O2中含有的质子数目为10NA | |
| D. | 1mol苯完全转化为环己烷,转移的电子数目为6NA |
13.设NA为阿伏伽德罗常数的值,则1molCu与足量的S完全反应,转移的电子数为( )
| A. | NA | B. | 1.5NA | C. | 2NA | D. | 不能确定 |
3.下列反应的离子方程式中正确的是( )
| A. | 铁与盐酸的反应:2Fe+6H+=2Fe3++3H2↑ | |
| B. | 石灰石与稀盐酸反应制备二氧化碳:CO32-+2H+=H2O+CO2↑ | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+=Cu2++Ag | |
| D. | 硫酸铜溶液和氢氧化钡溶液混合:Cu2++SO42-+Ba2++2OH-=Cu(OH)2↓+BaSO4↓ |