题目内容
16.(1)实验室用Na2CO3、10H2O晶体配制0.05mol/L的Na2CO3溶液970mL,应选用的容量瓶的规格1000mL,称取Na2CO3、10H2O的质量是14.3g.(2)2molO3和3molO2的质量之比为1:1,分子数之比为2:3,同温同压下的密度之比为3:2,含氧原子数之比为1:1.
(3)现有下列九种物质①AgCl②铜③液态醋酸④CO2⑤H2SO4⑥Ba(OH)2固体⑦酒精⑧稀硝酸⑨熔融FeCl3
①上述状态下可导电的是(填序号,下同)②⑧⑨,属于电解质的是①③⑤⑥⑨,属于非电解质的是④⑦.
②上述九种物质中有两种物质之间可发生离子反应H++OH-=H2O,该离子反应对应的化学方程式为Ba(OH)2+2HNO3=Ba(NO3)2+2H2O.
分析 (1)依据配制溶液体积选择合适的容量瓶,依据配制溶液体积,依据m=cVM计算需要溶质的质量;
(2)根据m=nM计算出氧气和臭氧的质量,再计算出二者质量之比;根据物质的量之比等于分子数之比解答;根据密度与摩尔质量成正比分析;根据二者中含有的氧原子的物质的量之比;
(3)①物质导电的原因是有自由移动的电子或自由移动的离子;
在水溶液中或者熔化状态下能完全电离的是电解质属于强电解质,只能部分电离的属于弱电解质;
在水溶液中和熔化状态下都不能导电的化合物属于非电解质,包括非金属氧化物、氨气和大多数有机物;
(2)H++OH-═H2O,表示可溶性强酸和可溶性强碱发生酸碱中和反应生成可溶性盐和水.
解答 解:(1)实验室用Na2CO3•10H2O晶体配制0.05mol/L的Na2CO3溶液970mL,因为实验室没有970mL容量瓶,所以应选择1000mL容量瓶,实际配制1000mL溶液,需要Na2CO3•10H2O的质量为:m=0.05mol/L×286g/mol×1L=14.3g,
故答案为:1000mL;14.3g;
(2)2mol O3与3mol O2中都含有6mol氧原子,所以二者质量相等,质量之比为1:1;分子数之比等于二者物质的量之比,分子数之比为2:3;
同温同压下,气体的密度之比等于摩尔质量之比,所以臭氧和氧气的密度之比为:48:32=3:2;
二者中都含有6mol氧原子,氧原子数之比为1:1,
故答案为:1:1;2:3;3:2;1:1;
(3)①AgCl中离子不能自由移动,故不能导电;在熔融状态下能完全电离,故为强电解质;
②铜能导电;但铜是单质,故既不是电解质也不是非电解质;
③液态醋酸中无自由移动的离子,故不能导电;但在水溶液中能部分电离,故为弱电解质;
④CO2无自由移动的离子,故不能导电;在水溶液中导电和其本身无关,在熔融状态下不能导电,故为非电解质;
⑤H2SO4中无自由移动的离子,故不能导电;但在水溶液中能完全电离,故为强电解质;
⑥Ba(OH)2固体中无自由移动的离子,故不能导电;但在水溶液中和熔融状态下能完全电离,故为强电解质;
⑦酒精不导电,在溶液中也不导电,属于非电解质;
⑧稀硝酸有自由移动的离子,故能导电;但由于是混合物,故既不是电解质也不是非电解质;
⑨熔融NaCl中有自由移动的离子,故能导电;在水溶液中和熔融状态下能完全电离,故为强电解质,
②根据分析可知,能导电的为:②⑧⑨;是强电解质的是:①③⑤⑥⑨;是非电解质的是:④⑦;
故答案为:②⑧⑨;①③⑤⑥⑨;④⑦;
②离子方程式H++OH-═H2O表示可溶性强酸和可溶性强碱发生酸碱中和反应生成可溶性盐和水,故Ba(OH)2和HNO3的反应符合,化学方程式为:Ba(OH)2+2HNO3=Ba(NO3)2+2H2O,
故答案为:Ba(OH)2+2HNO3=Ba(NO3)2+2H2O.
点评 本题考查较为综合,涉及电解质与电解质的判断、阿伏伽德罗定律及推论、物质的量的计算等知识,试题知识点较多、综合性较强,充分考查了学生的分析能力及灵活应用能力.

 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案| A. | 100g98%的浓硫酸中含有的氢原子数目为2NA | |
| B. | 30g乙酸中含有的碳氢键数目为2NA | |
| C. | 16g16O2中含有的质子数目为10NA | |
| D. | 1mol苯完全转化为环己烷,转移的电子数目为6NA |
| A. | 0.1(y-2x)mol/L | B. | 10(2x-y)mol/L | C. | 10(y-x)mol/L | D. | 10(y-2x)mol/L |
| A. |  | B. |  | C. |  | D. |  |
| A. | 通入足量氨气:NH4+、SO42-、OH-、AlO2- | |
| B. | 加入足量Na2O2:Na+、Fe2+、SO42-、OH- | |
| C. | 加入过量稀硝酸:Al3+、Fe3+、H+、NO3-、SO42- | |
| D. | 加入过量漂白粉溶液:Ca2+、Fe2+、Cl-、ClO- |
| A. | c(H+)=1×10-14mol/L的溶液:K+、Cu2+、I-、SO42- | |
| B. | 水电离出的c(H+)=1×10-14mol/L的溶液:K+、Na+、AlO2-、S2O32- | |
| C. | 能与Al反应生成H2的溶液:NH4+、Ca2+、NO3-、I- | |
| D. | 使石蕊试液变蓝色的溶液:Mg2+、K+、SO 42-、NO3- |
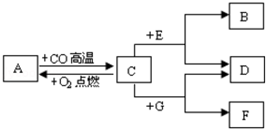 现有A、B、C、D、E、F、G七种物质,C、F是最常见的金属,B是气体单质,D为FeSO4溶液,G为CuSO4溶液,它们之间存在如图所示关系:
现有A、B、C、D、E、F、G七种物质,C、F是最常见的金属,B是气体单质,D为FeSO4溶液,G为CuSO4溶液,它们之间存在如图所示关系: