题目内容
15.在一定温度下,下列叙述不是可逆反应A(g)+2B(g)?2C(g)达到平衡状态标志的是( )①C的生成速率与C的分解速率相等;
②单位时间生成amol A,同时生成2amolB;
③A、B、C的浓度不再变化;
④混合气体平均摩尔质量不再变化
⑤混合气体的总压强不再变化;
⑥混合气体的物质的量不再变化;
⑦单位时间内消耗amol A,同时生成2amol B
⑧A、B、C的分子数比为1:3:2.
| A. | ②⑧ | B. | ①⑥ | C. | ②④ | D. | ③⑧ |
分析 可逆反应A(g)+2B(g)?2C(g)达到平衡状态时,正逆反应速率相等,各组分的浓度不再变化,据此进行判断.
解答 解:①C的生成速率与C的分解速率相等,表明正逆反应速率相等,该反应已经达到平衡状态,故①不选;
②单位时间生成amol A,同时生成2amolB,表示的都是逆反应速率,无法判断正逆反应速率是否相等,故②选;
③A、B、C的浓度不再变化,表明正逆反应速率相等,该反应已经达到平衡状态,故③不选;
④该反应前后气体的物质的量不相等,反应前后气体的质量不变,则混合气体的平均摩尔质量为变量,当混合气体平均摩尔质量不再变化,时,表明该反应达到平衡状态,故④不选;
⑤该反应前后气体的体积不相等,压强为变量,当当混合气体的总压强不再变化时,表明正逆反应速率相等,该反应达到平衡状态,故⑤不选;
⑥该反应前后气体体积不相等,当混合气体的物质的量不再变化时,表明正逆反应速率相等,该反应达到平衡状态,故⑥不选;
⑦单位时间内消耗amol A,同时生成2amol B,表明正逆反应速率相等,该反应达到平衡状态,故⑦不选;
⑧A、B、C的分子数比为1:3:2、,无法判断各组分的浓度是否变化,则无法判断是否达到平衡状态,故⑧选;
故选A.
点评 本题考查了化学平衡状态的判断,题目难度不大,明确化学平衡状态的特征为解答关键,注意掌握化学平衡及其影响,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
2.下列反应可以一步完成的是( )
| A. | Fe→Fe(OH)2→Fe(OH)3 | B. | Cl2→HClO→HCl | C. | S→SO3→H2SO4 | D. | Si→SiO2→H2SiO3 |
3.NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 100g98%的浓硫酸中含有的氢原子数目为2NA | |
| B. | 30g乙酸中含有的碳氢键数目为2NA | |
| C. | 16g16O2中含有的质子数目为10NA | |
| D. | 1mol苯完全转化为环己烷,转移的电子数目为6NA |
3.下列反应的离子方程式中正确的是( )
| A. | 铁与盐酸的反应:2Fe+6H+=2Fe3++3H2↑ | |
| B. | 石灰石与稀盐酸反应制备二氧化碳:CO32-+2H+=H2O+CO2↑ | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+=Cu2++Ag | |
| D. | 硫酸铜溶液和氢氧化钡溶液混合:Cu2++SO42-+Ba2++2OH-=Cu(OH)2↓+BaSO4↓ |
10.高铁酸钾(K2FeO4)是一种新型多功能水处理剂.其生产工艺的部分流程如下,下列说法正确的是( )


| A. | 在除去KCl的过程中必须用到过滤操作 | |
| B. | 在Cl2与KOH反应时,KOH作还原剂 | |
| C. | 在溶液A中加入KOH固体的作用是使KClO3转化为KClO | |
| D. | 在溶液A中加入KOH固体的作用是放出更多的热量,有利于提高反应速率 |
7.把300ml含有氯化钡和氯化钠的混合溶液分成三等份,取一份加入含x mol硫酸钾的溶液,恰好使钡离子完全沉淀;另取一份加入含y mol硝酸银的溶液,恰好使氯离子完全沉淀.则该混合溶液中钠离子的物质的量浓度为( )
| A. | 0.1(y-2x)mol/L | B. | 10(2x-y)mol/L | C. | 10(y-x)mol/L | D. | 10(y-2x)mol/L |
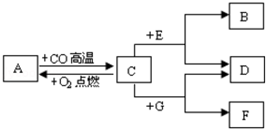 现有A、B、C、D、E、F、G七种物质,C、F是最常见的金属,B是气体单质,D为FeSO4溶液,G为CuSO4溶液,它们之间存在如图所示关系:
现有A、B、C、D、E、F、G七种物质,C、F是最常见的金属,B是气体单质,D为FeSO4溶液,G为CuSO4溶液,它们之间存在如图所示关系: