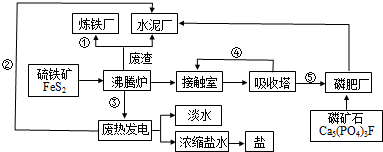
题目内容
9.下列叙述正确的是( )| A. | 钢铁吸氧腐蚀过程中正极反应为2H++2e-═H2↑ | |
| B. | 惰性电极电解熔融NaCl时阴极、阳极产生气体体积比为1:1 | |
| C. | H2在反应Li2NH+H2═LiNH2+LiH中既是氧化剂又是还原剂 | |
| D. | 用铁做电极电解CuCl2溶液的离子方程式为Cu2++2Cl-$\frac{\underline{\;电解\;}}{\;}$Cu+Cl2↑ |
分析 A.钢铁吸氧腐蚀,正极上氧气得到电子;
B.惰性电极电解熔融NaCl,生成Na、氯气;
C.只有H元素的化合价变化;
D.用铁做电极电解CuCl2溶液,阳极Fe失去电子,阴极铜离子得到电子.
解答 解:A.钢铁吸氧腐蚀,正极上氧气得到电子,正极反应为O2+2H2O+4e-═4OH-,故A错误;
B.惰性电极电解熔融NaCl,生成Na、氯气,阴极上不生成气体,故B错误;
C.只有H元素的化合价变化,则H2在反应Li2NH+H2═LiNH2+LiH中既是氧化剂又是还原剂,故C正确;
D.用铁做电极电解CuCl2溶液,阳极Fe失去电子,阴极铜离子得到电子,则铁做电极电解CuCl2溶液的离子方程式为Cu2++Fe-$\frac{\underline{\;电解\;}}{\;}$Cu+Fe2+,故D错误;
故选C.
点评 本题考查原电池及电解池,为高频考点,把握工作原理及电极反应为解答的关键,侧重分析与应用能力的考查,注意电化学知识的应用,题目难度不大.

练习册系列答案
相关题目
1.以含有Ca2+、Mg2+、Cl-、SO42-、Br-等离子的卤水为主要原料可制备金属镁和溴.流程如图1:
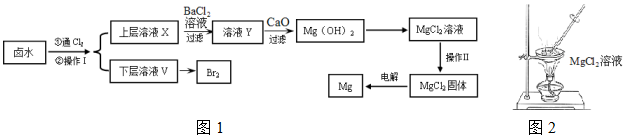
(1)操作Ⅰ的名称是萃取分液,所用主要玻璃仪器的名称是分液漏斗、烧杯;需要选择的试剂是c(填序号).
a.乙醇 b.苯 c.四氯化碳 d.裂化汽油
(2)通氯气反应的离子方程式Cl2+2Br-=2Cl-+Br2.
(3)证明SO42-完全沉淀的方法是静置向上层清液中继续加入BaCl2溶液,若不产生白色沉淀则证明SO42-已沉淀完全.
(4)CaO用来调节溶液Y的pH,可以使Mg2+沉淀完全,由表中数据可知,理论上应控制pH范围是11.0<pH<12.2.
(5)操作Ⅱ用图2所示操作不能实现(填“能”或“不能”).原因是MgCl2+2H2O?Mg(OH)2+2HCl(用化学方程式解释).
(6)工业上用惰性电极电解熔融状态下的氯化镁来冶炼镁,不能直接电解氯化镁溶液的原因是Mg2++2H2O+2Cl-$\frac{\underline{\;通电\;}}{\;}$Mg(OH)2↓+H2↑+Cl2↑(用离子方程式表示).
(7)在探究Mg(OH)2溶解性的实验中,发现向装有少量Mg(OH)2浊液的试管中加入适量NH4Cl晶体,充分振荡后浊液会变澄清,请用化学平衡的原理解释浊液变澄清的原因Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),NH4Cl电离出的NH4+与OH?结合成弱电解质一水合氨,降低了c(OH-),Mg(OH)2溶解平衡向右移动.

(1)操作Ⅰ的名称是萃取分液,所用主要玻璃仪器的名称是分液漏斗、烧杯;需要选择的试剂是c(填序号).
a.乙醇 b.苯 c.四氯化碳 d.裂化汽油
(2)通氯气反应的离子方程式Cl2+2Br-=2Cl-+Br2.
(3)证明SO42-完全沉淀的方法是静置向上层清液中继续加入BaCl2溶液,若不产生白色沉淀则证明SO42-已沉淀完全.
(4)CaO用来调节溶液Y的pH,可以使Mg2+沉淀完全,由表中数据可知,理论上应控制pH范围是11.0<pH<12.2.
| 开始沉淀时 | 沉淀完全时 | |
| Mg2+ | pH=9.6 | pH=11.0 |
| Ca2+ | pH=12.2 | c(OH-)=1.8mol/L |
(6)工业上用惰性电极电解熔融状态下的氯化镁来冶炼镁,不能直接电解氯化镁溶液的原因是Mg2++2H2O+2Cl-$\frac{\underline{\;通电\;}}{\;}$Mg(OH)2↓+H2↑+Cl2↑(用离子方程式表示).
(7)在探究Mg(OH)2溶解性的实验中,发现向装有少量Mg(OH)2浊液的试管中加入适量NH4Cl晶体,充分振荡后浊液会变澄清,请用化学平衡的原理解释浊液变澄清的原因Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),NH4Cl电离出的NH4+与OH?结合成弱电解质一水合氨,降低了c(OH-),Mg(OH)2溶解平衡向右移动.
19.下列有关化学用语的表示正确的是( )
| A. | H2O2的电子式: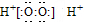 | |
| B. | 氮原子最外层电子轨道表达式: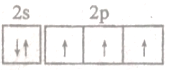 | |
| C. | Cl中子数为18的氯原子结构示意图: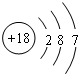 | |
| D. | 碳酸氢钠的电离方程式:NaHCO3?Na++H++CO32- |
14.一定量的锌粉和3mol/L的过量盐酸反应,当向其中加入少量的下列物质时,能够加快反应速率,又不影响产生H2的总量的是( )
①石墨粉②CH3COONa固体③铜粉④铁粉⑤6mol/L盐酸.
①石墨粉②CH3COONa固体③铜粉④铁粉⑤6mol/L盐酸.
| A. | ①②⑤ | B. | ①③⑤ | C. | ③④⑤ | D. | ①③④ |
1.如图所示的装置能够组成原电池产生电流的是( )
| A. |  Na2SO4溶液 | B. |  FeCl3溶液 | C. |  稀盐酸 | D. |  酒精 |
18.下列离子方程式书写正确的是( )
| A. | 钠与CuSO4溶液反应:2Na+Cu2+═Cu+2Na+ | |
| B. | 稀H2SO4和Ba(OH)2溶液反应:H++SO42-+Ba2++OH-═BaSO4+H2O | |
| C. | 少量SO2通入苯酚钠溶液中:C6H5O-+SO2+H2O═2C6H5OH+SO32- | |
| D. | 醋酸钠的水解反应:CH3COO-+H3O+═CH3COOH+H2O |
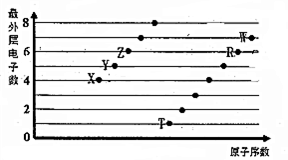 部分短周期元素原子最外层电子数与原子序数的关系如图,回答下列问题:
部分短周期元素原子最外层电子数与原子序数的关系如图,回答下列问题: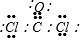 ;已知1mol XZW2与4mol NaOH
;已知1mol XZW2与4mol NaOH