题目内容
12.纳米材料镍粉(Ni)是一种高性能电极材料.其制备过程如下:步骤I:取0.2mol•L-1的硝酸镍溶液,调节pH除铁后,加入活性炭过滤.
步骤Ⅱ:向所得滤液中滴加1.5mol•L-1的NaHCO3溶液使Ni2+完全沉淀,生成xNiCO3•yNi(OH)2•zH2O.
步骤Ⅲ:将产生的沉淀用大量高纯水清洗并用离心机甩干.
步骤Ⅳ:加入稍过量的肼溶液(N2H4•H2O),使上述沉淀还原完全,将生成的Ni水洗后,再用95%的乙醇浸泡后晾干.
(1)步骤I中去除杂质Fe3+(使其浓度<10-6mol•L-1),需调节溶液pH的范围为3~7.(Ksp[Ni(OH)2]=2×10-15,Ksp[Fe(OH)3]=1×10-39)
(2)当x:y:z=1:1:1时,写出步骤Ⅱ中产生沉淀的离子方程式:2Ni2++4HCO3-=NiCO3•Ni(OH)2•H2O↓+3CO2↑.
(3)步骤Ⅳ中采用95%的乙醇浸泡的目的是除去水,便于快速晾干.
(4)为测定xNiCO3•yNi(OH)2•zH2O的组成,进行如下实验:
①准确称取7.54g样品与过量的肼溶液(N2H4•H2O)充分反应,共收集到1.12LN2和CO2混合气体(已换算成标准状况).
②另取等质量的样品充分灼烧,冷却后称得残留固体NiO的质量为4.5g.通过计算确定xNiCO3•yNi(OH)2•zH2O的化学式(写出计算过程).
分析 (1)已知:c(Ni2+)=0.2mol/L,去除杂质Fe3+(使其浓度<10-6mol•L-1),而不除去镍离子,应满足c(Fe3+)×c3(OH-)>1×10-39,c(Ni2+)×c2(OH-)<2×10-15,以此可计算c(OH-),进而计算pH;
(2)当x:y:z=1:1:1时,向所得滤液中滴加1.5mol•L-1的NaHCO3溶液使Ni2+完全沉淀,生成NiCO3•Ni(OH)2•H2O,根据质量守恒书写即可;
(3)乙醇与水混溶,易挥发,除去水,便于快速晾干;
(4)根据共收集到1.12LN2和CO2,残留固体NiO的质量为4.5g,则n(CO2)+n(N2)=$\frac{1.12L}{22.4L•mol-1}$=0.05mol;n(NiO)=$\frac{4.5g}{75g•mol-1}$=0.06mol,
设7.54g样品中含有NiCO3、Ni(OH)2的物质的量分别为a、b,则有:
a+$\frac{a+b}{2}$=0.05mol
a+b=0.06mol
解得a、b,由此计算结晶水的物质的量,可得.
解答 解:(1)已知:Ksp[Ni(OH)2]=c(Ni2+)×c2(OH-)=2×10-15,Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)=1×10-39,去除杂质Fe3+(使其浓度<10-6mol•L-1),则c(OH-)>$\root{3}{\frac{1×1{0}^{-39}}{1×1{0}^{-6}}}$=10-11mol•L-1,pH>3,不沉淀镍离子,则c(OH-)<$\sqrt{\frac{2×1{0}^{-15}}{0.2}}$=10-7mol•L-1,pH<7,pH的范围为3~7;
故答案为:3~7;
(2)当x:y:z=1:1:1时,向所得滤液中滴加1.5mol•L-1的NaHCO3溶液使Ni2+完全沉淀,生成NiCO3•Ni(OH)2•H2O,离子方程式为:2Ni2++4HCO3-=NiCO3•Ni(OH)2•H2O↓+3CO2↑;
故答案为:2Ni2++4HCO3-=NiCO3•Ni(OH)2•H2O↓+3CO2↑;
(3)乙醇与水混溶,易挥发,除去水,便于快速晾干;
故答案为:除去水,便于快速晾干;
(4)n(CO2)+n(N2)=$\frac{1.12L}{22.4L•mol-1}$=0.05mol;n(NiO)=$\frac{4.5g}{75g•mol-1}$=0.06mol,
设7.54g样品中含有NiCO3、Ni(OH)2的物质的量分别为a、b,则有:
a+$\frac{a+b}{2}$=0.05mol
a+b=0.06mol
解得:a=0.02 mol、b=0.04 mol,
7.54g样品中含有结晶水的物质的量:
n(H2O)=(7.54g-0.02mol×119 g•mol-1-0.04mol×93 g•mol-1)÷18 g•mol-1=0.08 mol
n(NiCO3):n[Ni(OH)2]:n (H2O)=0.02 mol:0.04 mol:0.08 mol=1:2:4
故该样品的化学式为NiCO3•2Ni(OH)2•4H2O;
答:该样品的化学式为NiCO3•2Ni(OH)2•4H2O.
点评 本题考查了物质的制备,涉及对反应原理的理解、氧化还原反应、对条件的控制选择与理解、溶度积的计算、物质组成测定的计算等,是对学生综合能力的考查,需要学生具备扎实的基础与数据处理能力,题目难度中等.

 精英口算卡系列答案
精英口算卡系列答案
| A. | 1 mol阿司匹林最多可消耗2 mol NaOH | |
| B. | 阿司匹林的分子式为C9H10O4 | |
| C. | 水杨酸可以发生取代、加成、氧化、加聚反应 | |
| D. | 服用阿司匹林,身体出现水杨酸不良反应时,可静脉注射NaHCO3溶液 |
| A. |  | B. |  | C. |  | D. |  |
| 选项 | 实验操作和现象 | 结论 |
| A | 室温下,向明矾溶液中溶液中加入足量的浓氨水 | 证明氢氧化铝溶于氨水 |
| B | 室温下,向浓度均为0.1mol•L-1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀. | Ksp(BaSO4)<Ksp(CaSO4) |
| C | 室温下,向硅酸钠溶液中通入足量的CO2出现白色沉淀. | 酸性:H2CO3>H2SiO3 |
| D | 室温下,用pH试纸测得:0.1mol•L-1 Na2SO3溶液的pH约为10;0.1mol•L-1 NaHSO3溶液的pH约为5. | HSO3-结合H+的能力比 SO32-的强 |
| A. | A | B. | B | C. | C | D. | D |
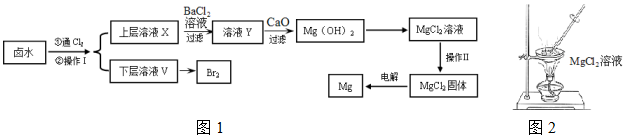
(1)操作Ⅰ的名称是萃取分液,所用主要玻璃仪器的名称是分液漏斗、烧杯;需要选择的试剂是c(填序号).
a.乙醇 b.苯 c.四氯化碳 d.裂化汽油
(2)通氯气反应的离子方程式Cl2+2Br-=2Cl-+Br2.
(3)证明SO42-完全沉淀的方法是静置向上层清液中继续加入BaCl2溶液,若不产生白色沉淀则证明SO42-已沉淀完全.
(4)CaO用来调节溶液Y的pH,可以使Mg2+沉淀完全,由表中数据可知,理论上应控制pH范围是11.0<pH<12.2.
| 开始沉淀时 | 沉淀完全时 | |
| Mg2+ | pH=9.6 | pH=11.0 |
| Ca2+ | pH=12.2 | c(OH-)=1.8mol/L |
(6)工业上用惰性电极电解熔融状态下的氯化镁来冶炼镁,不能直接电解氯化镁溶液的原因是Mg2++2H2O+2Cl-$\frac{\underline{\;通电\;}}{\;}$Mg(OH)2↓+H2↑+Cl2↑(用离子方程式表示).
(7)在探究Mg(OH)2溶解性的实验中,发现向装有少量Mg(OH)2浊液的试管中加入适量NH4Cl晶体,充分振荡后浊液会变澄清,请用化学平衡的原理解释浊液变澄清的原因Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),NH4Cl电离出的NH4+与OH?结合成弱电解质一水合氨,降低了c(OH-),Mg(OH)2溶解平衡向右移动.
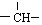 和一个-Cl,它的可能结构有四种,请写出它们的结构简式:CH3CH2CH2CHClCH3、CH3CH2CHClCH2CH3、CH3CH(CH3)CH2CH2Cl、CH2ClCH(CH3)CH2CH3.
和一个-Cl,它的可能结构有四种,请写出它们的结构简式:CH3CH2CH2CHClCH3、CH3CH2CHClCH2CH3、CH3CH(CH3)CH2CH2Cl、CH2ClCH(CH3)CH2CH3.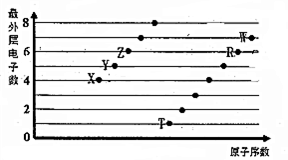 部分短周期元素原子最外层电子数与原子序数的关系如图,回答下列问题:
部分短周期元素原子最外层电子数与原子序数的关系如图,回答下列问题: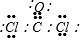 ;已知1mol XZW2与4mol NaOH
;已知1mol XZW2与4mol NaOH