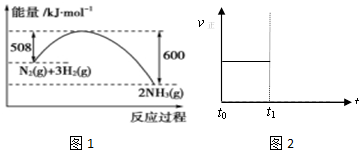
题目内容
7.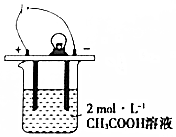 如图所示,烧杯中的溶液为2mol•L-1CH3COOH溶液,接通直流电源,分别向烧杯中加入下列物质(保持反应温度不变),灯泡变暗的是( )
如图所示,烧杯中的溶液为2mol•L-1CH3COOH溶液,接通直流电源,分别向烧杯中加入下列物质(保持反应温度不变),灯泡变暗的是( )| A. | 加入固体NaOH | B. | 加水稀释 | C. | 加入金属Na | D. | 通入HC1气体 |
分析 溶液的导电性与溶液中离子的电荷浓度有关,电荷浓度越大,溶液导电性越强,灯泡越亮,据此分析.
解答 解:A.CH3COOH是弱电解质,在溶液中部分电离,加入固体NaOH生成醋酸钠,生成强电解质,溶液中离子浓度增大,导电性增强,灯泡变亮,故A不选;
B.加水稀释,溶液中离子浓度减小,导电性减弱,灯泡变暗,故B选;
C.加入金属Na,生成醋酸钠,生成强电解质,溶液中离子浓度增大,导电性增强,灯泡变亮,故C不选;
D.通入HC1气体,HCl为强电解质,溶液中离子浓度增大,导电性增强,灯泡变亮,故D不选.
故选B.
点评 本题考查了弱电解质、溶液的导电性,题目难度不大,注意把握弱电解质的电离特点以及溶液导电性的因素,侧重于考查学生的分析能力和应用能力.

练习册系列答案
相关题目
17.下列微粒的结构示意图中氧族元素原子结构示意图的是( )
| A. |  | B. |  | C. |  | D. |  |
12.美国天文学家在亚利桑那州一天文观测台,探测到距银河系中心2.6亿光年处一巨大气云中的特殊电磁波,这种电磁波表明那里可能有乙醇醛糖(HOCH2CHO)分子存在,下列有关乙醇醛糖的说法不正确的是( )
| A. | HOCH2CHO能发生取代反应、加成反应、氧化反应 | |
| B. | 乙醇醛糖是一种有机物,能燃烧,可溶于水 | |
| C. | HOCH2CHO与乙酸、甲酸甲酯互为同分异构体 | |
| D. | 乙醇醛糖与葡萄糖具有相似的化学性质,且互为同系物 |
19.下列有关化学用语的表示正确的是( )
| A. | H2O2的电子式: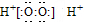 | |
| B. | 氮原子最外层电子轨道表达式: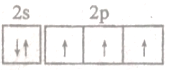 | |
| C. | Cl中子数为18的氯原子结构示意图: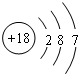 | |
| D. | 碳酸氢钠的电离方程式:NaHCO3?Na++H++CO32- |




 亚硫酸钠在存放过程中会因为被氧化而变质,某研究性学习小组的同学对一种亚硫酸钠样品是否变质及变质程度进行了探究.
亚硫酸钠在存放过程中会因为被氧化而变质,某研究性学习小组的同学对一种亚硫酸钠样品是否变质及变质程度进行了探究.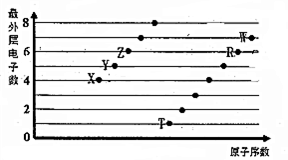 部分短周期元素原子最外层电子数与原子序数的关系如图,回答下列问题:
部分短周期元素原子最外层电子数与原子序数的关系如图,回答下列问题: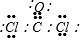 ;已知1mol XZW2与4mol NaOH
;已知1mol XZW2与4mol NaOH