题目内容
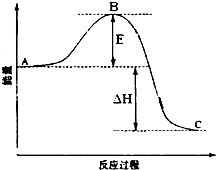 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3放出的热量99kJ.请回答下列问题:
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3放出的热量99kJ.请回答下列问题:(1)图中A、C分别表示
(2)图中△H=
(3)如果反应速率υ(SO2)为0.05mol?L-1?min-1,则υ(SO3)=
(4)已知单质硫的燃烧热为296KJ?mol-1,计算由S(s)生成3molSO3(g)的△H=
考点:活化能及其对化学反应速率的影响,有关反应热的计算,反应速率的定量表示方法
专题:
分析:(1)A、C分别表示反应物总能量的生成物总能量,B为活化能,活化能的大小与反应热无关;催化剂能够降低反应的活化能,不影响反应物和生成物能量高低;
(2)根据参加反应SO2的物质的量之比等于对应的△H之比;
(3)反应速率之比等于方程式的系数之比;
(4)根据热化学方程式利用盖斯定律计算即可.
(2)根据参加反应SO2的物质的量之比等于对应的△H之比;
(3)反应速率之比等于方程式的系数之比;
(4)根据热化学方程式利用盖斯定律计算即可.
解答:
解:(1)因图中A、C分别表示反应物总能量、生成物总能量,B为活化能,反应热可表示为A、C活化能的大小之差,活化能的大小与反应热无关,
催化剂能够降低反应的活化能,不影响反应物和生成物能量高低,
故答案为:A表示反应物总能量、C表示生成物总能量;无;降低;不变;
(2)因1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1,所以2molSO2(g)氧化为2molSO3的△H=-198kJ?mol-1,
则2SO2(g)+O2(g)=2SO3(g)△H=-198KJ?mol-1,故答案为:-198.
(3)二氧化硫和三氧化硫的反应速率之比等于方程式的系数之比,即为1:1,如果反应速率υ(SO2)为0.05mol?L-1?min-1,则υ(SO3)=0.05mol?L-1?min-1,
故答案为:0.05;
(4)已知①S(s)+O2(g)=SO2(g)△H1=-296 KJ?mol-1,②SO2(g)+
O2(g)=SO3(g)△H2=-99 KJ?mol-1;
则利用盖斯定律将①×3+②×3可得3 S(s)+
O2(g)=3SO3(g)△H3=3×(△H1+△H2)=-1185 KJ?mol-1,
故答案为:-1185 KJ?mol-1.
催化剂能够降低反应的活化能,不影响反应物和生成物能量高低,
故答案为:A表示反应物总能量、C表示生成物总能量;无;降低;不变;
(2)因1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1,所以2molSO2(g)氧化为2molSO3的△H=-198kJ?mol-1,
则2SO2(g)+O2(g)=2SO3(g)△H=-198KJ?mol-1,故答案为:-198.
(3)二氧化硫和三氧化硫的反应速率之比等于方程式的系数之比,即为1:1,如果反应速率υ(SO2)为0.05mol?L-1?min-1,则υ(SO3)=0.05mol?L-1?min-1,
故答案为:0.05;
(4)已知①S(s)+O2(g)=SO2(g)△H1=-296 KJ?mol-1,②SO2(g)+
| 1 |
| 2 |
则利用盖斯定律将①×3+②×3可得3 S(s)+
| 9 |
| 2 |
故答案为:-1185 KJ?mol-1.
点评:本题综合考查反应热与焓变,为高考常见题型,侧重于学生的分析能力和计算能力的考查,注意催化剂对反应的影响以及盖斯定律的应用.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
我国合成了一种新的元素A,科学家已经确定它的原子序数是115,请预测A周期表中的位置( )
| A、第7周期第 VA族 |
| B、第6周期第 VB族 |
| C、第7周期第ⅥA族 |
| D、第6周期第 VIIB族 |
地球大气是由多种物质形成的气体混合物,其中含量最高的元素为( )
| A、氮 | B、氦 | C、氢 | D、氧 |
向三份0.1mol/LCH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl2因体(忽略溶液体积变化,( CH3COO)2Fe为易溶于水的盐且完全电离),则CH3COO-浓度的变化依次为( )
| A、减小、增大、减小 |
| B、增大、减小、减小 |
| C、减小、增大、增大 |
| D、增大、减小、增大 |
下列反应属于放热反应的是( )
| A、焦炭和二氧化碳共热 |
| B、NaOH溶于水 |
| C、KClO3受热分解 |
| D、CaO溶于水 |
反应Fe2O3+3CO
2Fe+3CO2是工业炼铁的主要反应.该反应属于( )
| ||
| A、置换反应 | B、复分解反应 |
| C、氧化还原反应 | D、离子反应 |