题目内容
在含1mol NH4+,0.5mol Mg2+,1mol Al 3+,2mol H+的溶液中加入NaOH溶液,写出所有分步反应的离子方程式,并完成如图所示图象.

考点:离子方程式的有关计算
专题:
分析:由给出的离子可知,滴加NaOH溶液时开始发生H++OH-═H2O,然后与NH4+反应,再与Mg2+、Al3+结合OH-生成沉淀,氢氧化钠过量时,氢氧化铝沉淀又溶解,利用离子反应方程式及原子守恒来计算解答.
解答:
解:滴加NaOH溶液时开始发生H++OH-═H2O,2mol H+消耗2mol氢氧化钠;
继续加NaOH与Mg2+、Al3+结合OH-生成沉淀,Mg2++2OH-═Mg(OH)2↓,Al3++3OH-═Al(OH)3↓,0.5mol Mg2+消耗1molNaOH,1mol Al 3+消耗3molNaOH;
然后与NH4+反应NH4++OH-═NH3?H2O,1mol NH4+消耗1molNaOH;
氢氧化钠过量时,氢氧化铝沉淀又溶解发生的离子反应Al(OH)3+OH-═AlO2-+2H2O,1molAl(OH)3消耗1molNaOH;
其图象为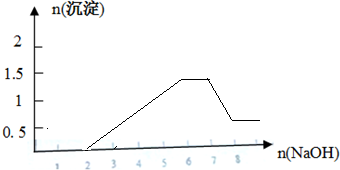 ;
;
答:所有分步反应的离子方程式为:H++OH-═H2O,Mg2++2OH-═Mg(OH)2↓,Al3++3OH-═Al(OH)3↓,NH4++OH-═NH3?H2O,Al(OH)3+OH-═AlO2-+2H2O;其图象为 .
.
继续加NaOH与Mg2+、Al3+结合OH-生成沉淀,Mg2++2OH-═Mg(OH)2↓,Al3++3OH-═Al(OH)3↓,0.5mol Mg2+消耗1molNaOH,1mol Al 3+消耗3molNaOH;
然后与NH4+反应NH4++OH-═NH3?H2O,1mol NH4+消耗1molNaOH;
氢氧化钠过量时,氢氧化铝沉淀又溶解发生的离子反应Al(OH)3+OH-═AlO2-+2H2O,1molAl(OH)3消耗1molNaOH;
其图象为
 ;
;答:所有分步反应的离子方程式为:H++OH-═H2O,Mg2++2OH-═Mg(OH)2↓,Al3++3OH-═Al(OH)3↓,NH4++OH-═NH3?H2O,Al(OH)3+OH-═AlO2-+2H2O;其图象为
 .
.
点评:本题考查了离子反应,涉及离子方程式的书写、计算和图象,题目难度中等,注意把握离子之间的反应原理是关键.

练习册系列答案
相关题目
天然碳元素的相对原子质量为12.01,若在自然界碳元素有12C、13C两种同位素,则12C与13C的质量比为( )
| A、等于1:99 |
| B、大于99:1 |
| C、等于99:1 |
| D、小于99:1 |
某气态烃0.5mol恰好与1molHCl加成,生成物分子中的氢又可被3molCl2取代,则此气态烃可能是( )
| A、C2H2 |
| B、C2H4 |
| C、CH2=C(CH3)2 |
| D、CH≡C-CH3 |
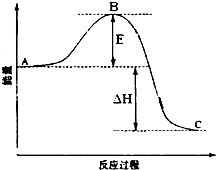 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3放出的热量99kJ.请回答下列问题:
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3放出的热量99kJ.请回答下列问题: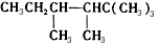
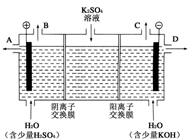 电化学知识是化学反应原理的重要部分,以下是常见的电化学装置:
电化学知识是化学反应原理的重要部分,以下是常见的电化学装置: