题目内容
8.催化剂是化工技术的核心,绝大多数的化工生产需采用催化工艺.(1)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生反应:2N2(g)+6H2O(1)?4NH3(g)+3O2(g)△H=+1530kJ•mol-1
又知:H2O(g)═H2O(1)△H=-44.0kJ•mol-1,4NH3(g)+3O2(g)?2N2(g)+6H2O(g)△H=-1266kJ•mol-1.在恒容密闭容器中,当该反应处于平衡状态时,欲使平衡向正反应方向移动且反应速率加快,下列措施可行的是B.(填字母)
A.向平衡混合物中充入Ar B.向平衡混合物中充入O2
C.采用更好的催化剂 D.降低反应的温度
 (2)①用氨气制取尿素[CO(NH2)]的反应为:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△H<0.
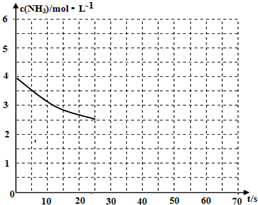
(2)①用氨气制取尿素[CO(NH2)]的反应为:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△H<0.某温度下,向容器为1L的密闭容器中通入4mol NH3和2molCO2,该反应进行到40s时,达到平衡,此时CO2的转化率为50%.图中的曲线表示在前25s内NH3的浓度随时间的变化.如果保持其他条件不变的情况下使用催化剂,请在图中用实线画出c(NH3)随时间的变化曲线.
②若保持其他条件不变,向平衡体系中再通入2molNH3和2molH2O,此时v正>v逆(填“>”、“=”或“<”)
分析 (1)①2N2(g)+6H2O(1)=4NH3(g)+3O2(g)△H=+1530kJ•mol-1
②又知:H2O(g)═H2O(1)△H=-44.0kJ•mol-1,
反应-(①+②)可以得到:4NH3(g)+3O2(g)=2N2(g)+6H2O(g),根据盖斯定律计算反应的△H;根据影响化学反应速率和平衡移动的因素来回答;
(2)①如果保持其他条件不变的情况下使用催化剂,则不会改变化学平衡移动,但是会加快反应速率,根据三行式计算平衡时氨气的浓度;
②若保持其他条件不变,向平衡体系中再通入2molNH3和2molH2O,根据Qc和K的关系判断反应进行的方向.
解答 解:(1)①2N2(g)+6H2O(1)=4NH3(g)+3O2(g)△H=+1530kJ•mol-1
②又知:H2O(g)═H2O(1)△H=-44.0kJ•mol-1,
反应-(①+②)可以得到:4NH3(g)+3O2(g)=2N2(g)+6H2O(g),根据盖斯定律,得到反应的△H=-(1530kJ•mol-1+44.0kJ•mol-1)=-1266kJ•mol-1;
A.向平衡混合物中充入Ar,在恒容密闭容器中,各组分浓度不变,所以速率不变,平衡不动,故A错误;
B.向平衡混合物中充入O2,正逆反应速率加快,平衡正向移动,故B正确;
C.采用更好的催化剂不会改变化学平衡移动,只是会加快反应速率,故C错误;
D.降低反应的温度会降低反应速率,故D错误,故答案为:-1266;B;
(2)①1L的密闭容器中通入4mol NH3和2molCO2,该反应进行到40s时,达到平衡,此时CO2的转化率为50%.
2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g)
初始浓度:4 2 0 0
变化浓度:2 1 1 1
平衡浓度:2 1 1 1
加入催化剂,不会改变化学平衡移动,但是会加快反应速率,得到c(NH3)随时间的变化曲线如下图所示: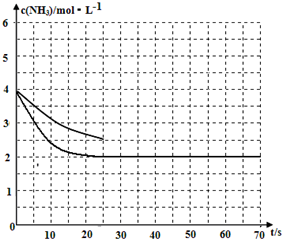 ,故答案为:
,故答案为: ;
;
②若保持其他条件不变,向平衡体系中再通入2molNH3和2molH2O,此时Qc=$\frac{3×1}{{4}^{2}×1}$<K=0.25,所以平衡会正向移动,v正>v逆.故答案为:>.
点评 本题考查了热化学方程式和盖斯定律的计算、图象分析,化学平衡计算,平衡常数概念的分析应用是解题关键,题目难度中等.

| 序号 | A | B | C |
| 装置 | 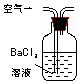 | 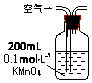 | 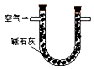 |
| 原理 | 通入V升空气,测定生成沉淀的质量 | 当KMnO4溶液刚好褪色时,测定通入空气的体积V | 通入V升空气,测定U型管增加的质量 |
已知:CO(g)+H2O(g)?H2(g)+CO2(g)的平衡常数随温度的变化如表:
| 温度℃ | 400 | 500 | 830 | 1 000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
(1)某温度下,上述反应达到平衡后,保持容器体积不变降低温度,平衡正向移动(填“正向移动”、“逆向移动”或“不移动”).
(2)在恒容绝热容器中,下列描述中能说明上述反应已达到平衡的是C
A、容器内混合气体分子总数不再发生变化
B、容器内混合气体的密度不再变化
C、$\frac{c(C{O}_{2})•c({H}_{2})}{c(CO)•c({H}_{2}O)}$不再变化
D、单位时间内消耗18g H2O同时生成1mol CO2
(3)830℃时,在恒容密闭容器中发生上述反应,按表中的物质的量投入反应混合物,其中向正反应方向进行的有AD(选填字母序号).
| A | B | C | D | |
| n(CO2)/mol | 0 | 1 | 3 | 1 |
| n(H2)/mol | 0 | 2 | 2 | 1 |
| n(CO)/mol | 3 | 0.5 | 1 | 2 |
| n(H2O)/mol | 3 | 2 | 5 | 2 |
(1)酸碱中和滴定--用标准盐酸滴定未知浓度的NaOH溶液.
①下列操作造成测定结果偏高的是AC
A.盛装未知液的锥形瓶先用蒸馏水洗过,再用未知液润洗
B.滴定终点读数时,俯视滴定管刻度,其他操作正确.
C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗
D.滴定前,酸式滴定管尖嘴无气泡,滴定后有气泡
②该学生的实验操作如下:
A、用碱式滴定管取稀NaOH 25.00mL,注入锥形瓶中,加入酚酞做指示剂.
B、用待测定的溶液润洗碱式滴定管.
C、用蒸馏水洗干净滴定管.
D、取下酸式滴定管用标准的HCl溶液润洗后,将标准液注入滴定管刻度“0”以上2~3cm处,再把滴定管固定好,调节液面至刻度“0”或“0”刻度以下.
E、检查滴定管是否漏水.
F、另取锥形瓶,再重复操作一次.
G、把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度.
滴定操作的正确顺序是(用序号填写)E→C→B→A→D→G→F
(2)氧化还原滴定--为了分析某残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行滴定,反应的离子方程式5Fe2++MnO${\;}_{4}^{-}$+8H+═5Fe3++Mn2++4H2O
①KMnO4标准溶液应盛装在酸式滴定管中(填“酸式”或“碱式”)
②某同学称取5.000g残留物,经预处理后在容量瓶中配制成100mL溶液,每次移取25.00mL试样溶液,用1.000×10-2 mol•L-1 KMnO4标准溶液滴定.四次实验消耗标准溶液的体积分别为19.90mL、20.00mL、20.10mL、20.60mL.计算该残留物中铁元素的质量分数是4.480%.
(3)沉淀滴定--滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶.
参考下表中的数据,若用AgNO3滴定NaSCN溶液,可选用的指示剂是C.
| 银盐 性质 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
| 溶解度(mol•L-1) | 1.34×10-6 | 7.1×10-7 | 1.1×10-8 | 6.5×10-5 | 1.0×10-6 |
| 化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 |
| H-H | 436 | C-F | 427 | H-S | 339 |
| S=S | 255 | C-C1 | 330 | H-F | 565 |
| C1-C1 | 243 | C-I | 218 | H-C1 | 431 |
| O=O | ? | H-O | 464 | H-Br | 366 |
(1)写出氢气在氯气中燃烧的热化学方程式:H2(g)+C12(g)=2HC1(g)△H=-183 kJ•mol-l.
(2)已知2H2(g)+S2(s)=2H2S(g)△H=-224.5kJ•mol-1和表中数值可计算出l mol S2(s)气化时将吸收 (填“吸收”或“放出”)4.5 kJ的热量.
(3)通过表来预测卤代烃RX在同样条件下发生碱性水解反应时,RF、RC1、RBr、RI(R相同)的反应活性由大到小的顺序是RI>RBr>RC1>RF.
(4)H2分别与O2(g)、S(s)、Se(s)、Te(s)单质反应生成1mol气态氢化物的反应热如下:
a.+99.7kJ•mol-1 b.+29.7kJ•mol-1 c.-20.6kJ•mol-1 d.-241.8kJ•mol-1
①表示生成1mol碲化氢反应热的是a(填字母代号).
②O=O的键能为500.4 kJ•mol-l.
③写出硫化氢气体与氧气反应生成固态硫和气态水的热化学方程式2H2S(g)+O2(g)=S2(s)+2H2O(g)△H=-259.1 kJ•mol-l.
 一定条件下,反应2NH3(g)?N2(g)+3H2(g)达到平衡时N2的体积分数与温度、压强的关系如图所示.下列说法正确的是( )
一定条件下,反应2NH3(g)?N2(g)+3H2(g)达到平衡时N2的体积分数与温度、压强的关系如图所示.下列说法正确的是( )| A. | 压强:p1>p2 | B. | b、c两点对应的平衡常数:Kc>Kb | ||
| C. | a点:2v(NH3)正═3v(H2)逆 | D. | a点:NH3的转化率为$\frac{1}{3}$ |
| A. | 阿司匹林 | B. | 青霉素 | C. | 麻黄素 | D. | 胃舒平 |