题目内容
13.化学键的键能是指气态原子间形成1mol化学键时释放的能量,也可以理解为破坏l mol化学键需要吸收的热量.如表中为一些键能数据(单位:kJ•mol-1)| 化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 |
| H-H | 436 | C-F | 427 | H-S | 339 |
| S=S | 255 | C-C1 | 330 | H-F | 565 |
| C1-C1 | 243 | C-I | 218 | H-C1 | 431 |
| O=O | ? | H-O | 464 | H-Br | 366 |
(1)写出氢气在氯气中燃烧的热化学方程式:H2(g)+C12(g)=2HC1(g)△H=-183 kJ•mol-l.
(2)已知2H2(g)+S2(s)=2H2S(g)△H=-224.5kJ•mol-1和表中数值可计算出l mol S2(s)气化时将吸收 (填“吸收”或“放出”)4.5 kJ的热量.
(3)通过表来预测卤代烃RX在同样条件下发生碱性水解反应时,RF、RC1、RBr、RI(R相同)的反应活性由大到小的顺序是RI>RBr>RC1>RF.
(4)H2分别与O2(g)、S(s)、Se(s)、Te(s)单质反应生成1mol气态氢化物的反应热如下:
a.+99.7kJ•mol-1 b.+29.7kJ•mol-1 c.-20.6kJ•mol-1 d.-241.8kJ•mol-1
①表示生成1mol碲化氢反应热的是a(填字母代号).
②O=O的键能为500.4 kJ•mol-l.
③写出硫化氢气体与氧气反应生成固态硫和气态水的热化学方程式2H2S(g)+O2(g)=S2(s)+2H2O(g)△H=-259.1 kJ•mol-l.
分析 (1)根据旧键断裂和新键生成释放的能量之差即为反应焓变来判断;
(2)化学反应的反应热等于反应物的键能之和与生成物的键能之和的差,可以此来书写热化学方程式并计算反应热;
(3)RF、RCl、RBr、RI(R相同)的反应活性与卤代烃R-X键的键能大小有关;
(4)①同主族元素的单质从下到上,和氢气化合越来越容易,释放的热量越来越多,据此回答判断;
②化学反应的反应热等于反应物的键能之和与生成物的键能之和的差;
③旧键断裂和新键生成释放的能量之差即为反应焓变,根据热化学方程式的书写方法来回答.
解答 解:(1)化学反应的反应热等于反应物的键能之和与生成物的键能之和的差,热化学方程式H2(g)+Cl2(g)=2HCl(g);△H=427kJ/mol+218kJ/mol-2×431kJ/mol=-183kJ/mol,氢气在氯气中燃烧的热化学方程式为:H2(g)+C12(g)=2HC1(g)△H=-183 kJ•mol-l,
故答案为:H2(g)+C12(g)=2HC1(g)△H=-183 kJ•mol-l;
(2)由表中数据可得:2H2(g)+S2(g)=2H2S(g);△H=-229KJ•mol-1,又知2H2(g)+S2(s)→2H2S(g);△H=-224.5KJ•mol-1,则S2(s)→S2(g);△H=+4.5kJ/mol,1mol S2(s)气化时将吸收4.5kJ的能量,
故答案为:吸收;4.5;
(3)R相同时,卤素互化物的键能越大,越不易断裂,反应活性越小,所以RI>RBr>RCl>RF,
故答案为:RI>RBr>RCl>RF;
(4)①同主族元素的单质从下到上,和氢气化合越来越容易,释放的热量越来越多,表示生成1mol碲化氢反应热的是a,故答案为:a;
②化学反应的反应热等于反应物的键能之和与生成物的键能之和的差,H2分别与O2(g)反应生成1mol气态氢化物的反应热是-241.8kJ•mol-1,假设O=O的键能为x,所以2×436+x-464×4=-241.8kJ•mol-1,解得x=500.4 kJ•mol-l,故答案为:500.4 kJ•mol-l;
③旧键断裂和新键生成释放的能量之差即为反应焓变,2H2S(g)+O2(g)=S2(s)+2H2O(g),△H=(4×339+500.4-255-4×464)kJ/mol=-259.1 kJ•mol-l,
故答案为:2H2S(g)+O2(g)=S2(s)+2H2O(g)△H=-259.1 kJ•mol-l.
点评 本题考查新信息数据处理能力,根据反应的数据得出根据键能计算反应的规律,难度不大.

 名校课堂系列答案
名校课堂系列答案| A. | 1molN2与4molH2反应生成的NH3分子数为2NA | |
| B. | 14g乙烯和丙烯混合气体中的氢原子数为2NA | |
| C. | 1 molFe溶于过量硝酸,电子转移数为2NA | |
| D. | 标准状况下,2.24LCCl4含有的共价键数为0.4NA |
N2(g)+3H2(g)?2NH3(g)+Q(Q>0),
(1)该反应450℃的平衡常数>500℃时的平衡常数(填“>”、“<”或“=”).该反应达到平衡时混合气体的平均式量的范围是8.5<平均式量<17
(2)下列描述中能说明上述反应已达平衡的是BD
A、3V正(H2)=2V逆(NH3) B、容器中气体的平均分子量不随时间而变化
C、容器中气体的密度不随时间而变化 D、容器中气体的分子总数不随时间而变化
如上述反应若第5分钟时达到平衡,测得NH3的物质的量为0.2mol,计算从反应开始到平衡时,平均反应速率v(N2)为0.02mol/(L.min).
(3)下列研究目的和示意图相符的是C.
| A | B | C | D | |
| 研究目的 | 压强对反应的影响(P2>P1) | 温度对反应的影响 | 平衡体系增加N2对反应的影响 | 催化剂对反应的影响 |
| 图示 | 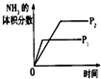 | 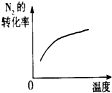 | 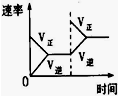 | 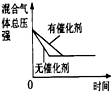 |
A、0.20mol/L B、0.16mol/L C、0.10mol/L D、0.05mol/L
在第5分钟末,保持其它条件不变,若继续通入0.2mol的N2和0.6mol的H2,则平衡向正反应方向移动(填“向正反应方向”“向逆反应方向”或“不”).
(1)仪器的洗涤:将2支滴定管和锥形瓶洗涤干净,滴定管还要润洗.
(2)在滴定管中装入相应的溶液,并记录好初读数
(3)用滴定管量取20.00ml的未知盐酸溶液于锥形瓶中,并加入2到3滴酚酞试液作为指示剂,振荡,摇匀.
(4)滴定操作:滴定时一手控制滴定管,一手摇动锥形瓶,眼睛观察锥形瓶内颜色的变化,当溶液颜色由无色变为浅红色,且半分钟内不变色时,则达滴定终点,记录读数.
(5)数据处理
| 实验次数 | 初读数(mL) | 末读数(mL) |
| 1 | 0.00 | 18.50 |
| 2 | 0.00 | 22.45 |
| 3 | 0.00 | 18.48 |
以上数据计算待测盐酸的物质的量浓度为0.1849mol/L.
| A. | 配制银氨溶液:在一定量AgNO3溶液中,滴加氨水至沉淀溶解 | |
| B. | 配制Cu(OH)2悬浊液:在一定量CuSO4溶液中,加入少量NaOH溶液 | |
| C. | 制备氯乙烷(C2H5Cl):将乙烷和氯气的混合气放在光照条件下反应 | |
| D. | 乙烯和乙醛均能使酸性KMnO4溶液褪色 |
 碱式碳酸铜是一种化工原料,化学式用mCu(OH)2•nCuCO3表示.实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
碱式碳酸铜是一种化工原料,化学式用mCu(OH)2•nCuCO3表示.实验室以废铜屑为原料制取碱式碳酸铜的步骤如下: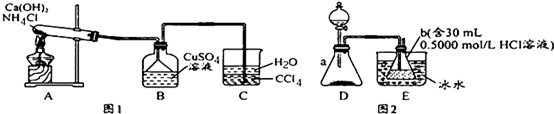
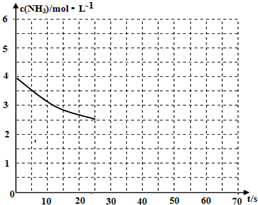 (2)①用氨气制取尿素[CO(NH2)]的反应为:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△H<0.
(2)①用氨气制取尿素[CO(NH2)]的反应为:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△H<0.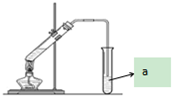 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题: ,该反应类型为取代反应;该反应中浓硫酸的作用是催化剂和吸水剂;
,该反应类型为取代反应;该反应中浓硫酸的作用是催化剂和吸水剂;