题目内容
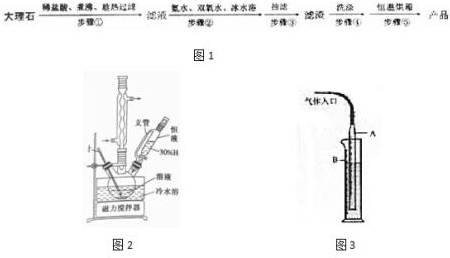
17.CaO2(过氧化钙)在医用防腐、消毒等方面应用广泛.它难溶于水、乙醇等溶剂,易溶于酸,温度过高易分解释放出氧气.实验室以大理石(含少量SiO2等杂质)为原料制备过氧化钙及含量测定如图1:(一)过氧化钙的制备流程
己知:CaC12+2NH3•H2O+H2O2+6H2O=CaO2•8H2O↓+2NH4Cl
(1)步骤①的具体操作为逐滴加入适量稀盐酸,将溶液煮沸,趁热过滤.将溶液煮沸的作用是除去溶液中溶解的二氧化碳.
(2)步骤②的装置示意图如图2,此步骤的关键是控制温度,其措施有冷水浴、磁力搅拌、缓慢滴加H2O2溶液.
(3)步骤⑤恒温烘箱的温度应控制在120℃左右的目的是使CaO2•8H2O分解成CaO2,同时又要注意防止温度过高使CaO2分解.
(二)过氧化钙的含量测定
方法一:取0.1350g产品于锥形瓶中,先酸化生成H2O2,再用标准KMnO4溶液滴定生成的H2O2,平行测定多次.
(4)上述酸化过程中,选用盐酸而不选用硫酸的可能原因是硫酸与CaO2反应生成硫酸钙是微溶的物质,覆盖在CaO2的表面,阻止反应进行.
方法二:取0.1350g产品于硬质玻璃管中,加热,收集气体,平行测定多次.
(5)方法二可用图3所示装置收集并测定气体的体积.
仪器A 的名称碱式滴定管;读取气体体积的具体方法上下移动碱式滴定管,使碱式滴定管与量筒的液面相平,平视凹液面底部,分别读取加气体前后的滴定管的刻度.
(6)方法二数据记录如表(标况下),产品中过氧化钙的含量80%(以质量分数表示).
| 测定次数 | 收集前读数/mL | 收集后读数/mL |
| 第1次 | 21.06 | 4.24 |
| 第2次 | 23.52 | 6.72 |
| 第3次 | 22.41 | 5.63 |
| 第4次 | 20.80 | 7.20 |
分析 由流程可知,碳酸钙溶于盐酸后,至溶液中尚存有少量固体,过滤后,滤液中氯化钙、氨水、过氧化氢反应生成CaO2、NH4Cl、水;再过滤,洗涤得到过氧化钙;制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品,石灰石便宜易得,但纯度较低,以此来解答,
(1)将溶液煮沸的作用是除去溶液中二氧化碳;
(2)反应②是滤液中加入氨水和过氧化氢冰水浴中反应生成过氧化钙晶体;过氧化氢热易分解,该反应需要在冰浴下、磁力搅拌、缓慢滴加H2O2溶液;
(3)步骤⑤恒温烘箱的目的是要将CaO2•8H2O分解成CaO2,同时又要注意防止温度过高使CaO2分解;
(4)硫酸与CaO2反应生成硫酸钙是微溶的物质,会使CaO2不能进一步反应;
(5)根据装置力可知仪器的名称,读取气体的体积时要注意先使气体冷却到室温,再将滴定管中的液面高度调整到与量筒内的液面在同一水平面上,再平衡视凹液面;
(6)根据图中数据可知,第1次的气体的体积为16.82mL,第2次的气体的体积为16.80mL,第3次的气体的体积为16.78mL,第4次的气体的体积为13.60mL,其中第四次与其它各次误差较大,应为绝对误差,应去掉,所以实验中收集到的气体的体积平均值为16.80mL,根据关系2CaO2~O2,由氧气的体积可计算出过氧化钙的含量.
解答 解:(1)步骤①的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,溶液中溶解二氧化碳,将溶液煮沸,趁热过滤,将溶液煮沸的作用是除去溶液中溶解的二氧化碳,
故答案为:除去溶液中溶解的二氧化碳;
(2)反应②是滤液中加入氨水和过氧化氢冰水浴中反应生成过氧化钙晶体,过氧化氢热易分解,该反应需要在冰浴下、磁力搅拌、缓慢滴加H2O2溶液,
故答案为:缓慢滴加H2O2溶液;
(3)步骤⑤恒温烘箱的目的是要将CaO2•8H2O分解成CaO2,同时又要注意防止温度过高使CaO2分解,所以温度应控制在120℃左右,
故答案为:使CaO2•8H2O分解成CaO2,同时又要注意防止温度过高使CaO2分解;
(4)硫酸与CaO2反应生成硫酸钙是微溶的物质,覆盖在CaO2的表面,会使CaO2不能进一步反应,
故答案为:硫酸与CaO2反应生成硫酸钙是微溶的物质,覆盖在CaO2的表面,阻止反应进行;
(5)根据装置图可知A 的仪器的名称为碱式滴定管,读取气体体积的具体方法是上下移动碱式滴定管,使碱式滴定管与量筒的液面相平,平视凹液面底部,分别读取加气体前后的滴定管的刻度,
故答案为:碱式滴定管;上下移动碱式滴定管,使碱式滴定管与量筒的液面相平,平视凹液面底部,分别读取加气体前后的滴定管的刻度;
(6)根据图中数据可知,第1次的气体的体积为16.82mL,第2次的气体的体积为16.80mL,第3次的气体的体积为16.78mL,第4次的气体的体积为13.60mL,其中第四次与其它各次误差较大,应为绝对误差,应去掉,所以实验中收集到的气体的体积平均值为16.80mL,根据关系2CaO2~O2可知,过氧化钙的质量为$\frac{16.8}{22.4}$×10-3×144g=0.1080g,过氧化钙的含量为$\frac{0.1080}{0.1350}$×100%=80%,
故答案为:80%.
点评 本题以过氧化钙的制备为载体考查了实验方案设计,重点考查了工艺流程的理解、对操作的分析评价、阅读获取信息的能力、化学计算等,准确获取题目中有用的信息进行利用是解本题的关键,题目难度中等.

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案N2(g)+3H2(g)?2NH3(g)+Q(Q>0),
(1)该反应450℃的平衡常数>500℃时的平衡常数(填“>”、“<”或“=”).该反应达到平衡时混合气体的平均式量的范围是8.5<平均式量<17
(2)下列描述中能说明上述反应已达平衡的是BD
A、3V正(H2)=2V逆(NH3) B、容器中气体的平均分子量不随时间而变化
C、容器中气体的密度不随时间而变化 D、容器中气体的分子总数不随时间而变化
如上述反应若第5分钟时达到平衡,测得NH3的物质的量为0.2mol,计算从反应开始到平衡时,平均反应速率v(N2)为0.02mol/(L.min).
(3)下列研究目的和示意图相符的是C.
| A | B | C | D | |
| 研究目的 | 压强对反应的影响(P2>P1) | 温度对反应的影响 | 平衡体系增加N2对反应的影响 | 催化剂对反应的影响 |
| 图示 | 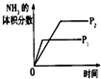 | 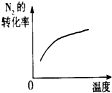 | 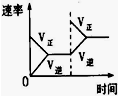 | 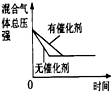 |
A、0.20mol/L B、0.16mol/L C、0.10mol/L D、0.05mol/L
在第5分钟末,保持其它条件不变,若继续通入0.2mol的N2和0.6mol的H2,则平衡向正反应方向移动(填“向正反应方向”“向逆反应方向”或“不”).
(1)仪器的洗涤:将2支滴定管和锥形瓶洗涤干净,滴定管还要润洗.
(2)在滴定管中装入相应的溶液,并记录好初读数
(3)用滴定管量取20.00ml的未知盐酸溶液于锥形瓶中,并加入2到3滴酚酞试液作为指示剂,振荡,摇匀.
(4)滴定操作:滴定时一手控制滴定管,一手摇动锥形瓶,眼睛观察锥形瓶内颜色的变化,当溶液颜色由无色变为浅红色,且半分钟内不变色时,则达滴定终点,记录读数.
(5)数据处理
| 实验次数 | 初读数(mL) | 末读数(mL) |
| 1 | 0.00 | 18.50 |
| 2 | 0.00 | 22.45 |
| 3 | 0.00 | 18.48 |
以上数据计算待测盐酸的物质的量浓度为0.1849mol/L.
| A. | Ba2+、SO42-,Fe3+、K+ | B. | OH-、C1-、Na+ | ||
| C. | NH4+、NO3-、A13+、K+ | D. | HCO3-、SO42-、Na+、H+ |
| A. | Cs+、K+、Mg2+、Al3+ | B. | F、F-、Cl-、Br- | ||
| C. | Ca2+、K+、S2-、Cl- | D. | Al、Al3+、Mg、K |
 (2)①用氨气制取尿素[CO(NH2)]的反应为:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△H<0.
(2)①用氨气制取尿素[CO(NH2)]的反应为:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△H<0. 肼(N2H4)广泛用于火箭推进剂、有机合成及电池燃料.请回答下列问题:
肼(N2H4)广泛用于火箭推进剂、有机合成及电池燃料.请回答下列问题: