题目内容
16.目前工业合成氨的原理是N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ•mol-1.(1)已知一定条件下:2N2(g)+6H2O(l)?4NH3(g)+3O2(g)△H=+1 530.0kJ•mol-1.则氢气燃烧热的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-286kJ/mol.
(2)如图1,在恒温恒容装置中进行合成氨反应.
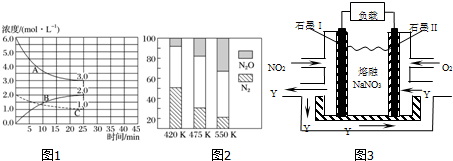
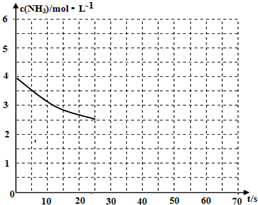
①表示N2浓度变化的曲线是C.
②前25min内,用H2浓度变化表示的化学反应速率是0.12 mol•L-1•min-1.
③在25min末刚好平衡,则平衡常数K=$\frac{4}{27}$.
(3)在恒温恒压装置中进行工业合成氨反应,下列说法正确的是AD.
A.气体体积不再变化,则已平衡
B.气体密度不再变化,尚未平衡
C.平衡后,往装置中通入一定量Ar,压强不变,平衡不移动
D.平衡后,压缩容器,生成更多NH3
(4)电厂烟气脱氮的主反应:①4NH3(g)+6NO(g)?5N2(g)+6H2O(g)△H<0,
副反应:②2NH3(g)+8NO(g)?5N2O(g)+3H2O(g)△H>0.
平衡混合气中N2与N2O含量与温度的关系如图2.
请回答:在400~600K时,平衡混合气中N2含量随温度的变化规律是随温度升高,N2的含量降低,导致这种规律的原因是主反应为放热反应,升温使主反应的平衡左移或者副反应为吸热反应,升温使副反应的平衡右移,降低了NH3和NO浓度,使主反应的平衡左移(任答合理的一条原因).
(5)以NO2、O2、熔融NaNO3组成的燃料电池装置如图3所示,石墨 I 极反应生成一种氧化物Y,有关电极反应可表示为NO2+NO3--e-=N2O5;为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,即必须在石墨Ⅱ电极处通入一种氧化物Y,Y是N2O5(填物质的化学式).
分析 (1)已知:①2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H=+l530.0kJ•mol-1,
②N2(g)+3H2(g)=2NH3(g)△H=-93.0kJ•mol-1,
根据盖斯定律,(②×2-①)÷6可得:H2(g)+$\frac{1}{2}$O2(g)=H2O(l);
(2)①根据图象可知,反应进行到25min时曲线A减少了6mol/L-3mol/L=3mol/L,C减少了2.0mol/L-1.0mol/L=1.0mol/L,因此根据方程式可知表示N2浓度变化的曲线是C;
②前25 min内,氢气浓度减少了3mol/L,根据v=$\frac{△c}{△t}$计算用H2浓度变化表示的化学反应速率;
③在25 min末刚好平衡,此时氮气、氢气和氨气的浓度分别是1.0mol/L、3mol/L、2mol/L,再根据K=$\frac{c{\;}^{2}(NH{\;}_{3})}{c(N{\;}_{2})×c{\;}^{3}(H{\;}_{2})}$计算平衡常数;
(3)A.正反应是体积减少的可逆反应,因此在恒温恒压下气体体积不再变化时已平衡;
B.在反应过程中质量始终不变,但容器容积是变化的,所以密度是变化的,因此气体密度不再变化说明反应达到平衡;
C.平衡后,往装置中通入一定量Ar,压强不变,容器容积增加,浓度降低,平衡向逆反应方向移动;
D.平衡后,压缩容器,压强增大,平衡向正反应方向进行;
(4)根据图2中随着温度升高,氮气、N2O的含量变化进行分析;根据温度对化学平衡影响及两个可逆反应的反应热情况进行分析;
(5)燃料电池的负极上发生燃料失去电子的氧化反应,据此分析.
解答 解:(1)已知:①2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H=+l530.0kJ•mol-1,
②N2(g)+3H2(g)=2NH3(g)△H=-93.0kJ•mol-1,
根据盖斯定律,(②×2-①)÷6可得:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-286kJ/mol
故答案为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-286kJ/mol;
(2)①根据图象可知,反应进行到25min时曲线A减少了6mol/L-3mol/L=3mol/L,C减少了2.0mol/L-1.0mol/L=1.0mol/L,因此根据方程式可知表示N2浓度变化的曲线是C;故答案为:C;
②前25 min内,氢气浓度减少了3mol/L,则用H2浓度变化表示的化学反应速率是3mol/L÷25min=0.12 mol•L-1•min-1,
故答案为:0.12 mol•L-1•min-1;
③在25 min末刚好平衡,此时氮气、氢气和氨气的浓度分别是1.0mol/L、3mol/L、2mol/L,则平衡常数K=$\frac{c{\;}^{2}(NH{\;}_{3})}{c(N{\;}_{2})×c{\;}^{3}(H{\;}_{2})}$=$\frac{2{\;}^{2}}{1×3{\;}^{3}}$=$\frac{4}{27}$,
故答案为:$\frac{4}{27}$;
(3)A.正反应是气体物质的量减小的反应,恒温恒压下,随反应进行体积减少,因此在恒温恒压下气体体积不再变化时已平衡,故A正确;
B.在反应过程中质量始终不变,但容器容积是变化的,所以密度是变化的,因此气体密度不再变化说明反应达到平衡,故B错误;
C.平衡后,往装置中通入一定量Ar,压强不变,容器容积增加,浓度降低,平衡向逆反应方向移动,故C错误;
D.平衡后,压缩容器,压强增大,平衡向正反应方向进行,因此生成更多NH3,故D正确,
故选:AD;
(4)根据图象可知,在400K~600K时,平衡混合气中N2含量随温度的升高逐渐降低;主反应为放热反应,升高温度,平衡向着逆向移动,氮气的含量减小,
故答案为:随温度升高,N2的含量降低;主反应为放热反应,升温使主反应的平衡左移或者副反应为吸热反应,升温使副反应的平衡右移,降低了NH3和NO浓度,使主反应的平衡左移;
(5)燃料电池的负极上发生燃料失去电子的氧化反应,即NO2+NO3--e-=N2O5,负极生成N2O5,为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,即必须在石墨电极Ⅱ电极处通入N2O5,
故答案为:NO2+NO3--e-=N2O5;N2O5.
点评 本题考查盖斯定律、化学平衡图象、化学平衡移动的影响因素、原电池原理的应用和电极反应书写,难度不大,注意对基础知识的理解掌握.

 快乐5加2金卷系列答案
快乐5加2金卷系列答案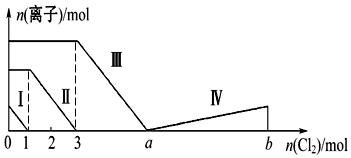
| A. | 线段Ⅱ表示Br-的变化情况 | B. | 原溶液中n(FeBr2):n(FeI2)=1:3 | ||
| C. | 线段Ⅳ表示IO3-的变化情况 | D. | 根据图象无法计算a的值 |
N2(g)+3H2(g)?2NH3(g)+Q(Q>0),
(1)该反应450℃的平衡常数>500℃时的平衡常数(填“>”、“<”或“=”).该反应达到平衡时混合气体的平均式量的范围是8.5<平均式量<17
(2)下列描述中能说明上述反应已达平衡的是BD
A、3V正(H2)=2V逆(NH3) B、容器中气体的平均分子量不随时间而变化
C、容器中气体的密度不随时间而变化 D、容器中气体的分子总数不随时间而变化
如上述反应若第5分钟时达到平衡,测得NH3的物质的量为0.2mol,计算从反应开始到平衡时,平均反应速率v(N2)为0.02mol/(L.min).
(3)下列研究目的和示意图相符的是C.
| A | B | C | D | |
| 研究目的 | 压强对反应的影响(P2>P1) | 温度对反应的影响 | 平衡体系增加N2对反应的影响 | 催化剂对反应的影响 |
| 图示 |  |  | 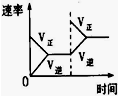 |  |
A、0.20mol/L B、0.16mol/L C、0.10mol/L D、0.05mol/L
在第5分钟末,保持其它条件不变,若继续通入0.2mol的N2和0.6mol的H2,则平衡向正反应方向移动(填“向正反应方向”“向逆反应方向”或“不”).
 碱式碳酸铜是一种化工原料,化学式用mCu(OH)2•nCuCO3表示.实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
碱式碳酸铜是一种化工原料,化学式用mCu(OH)2•nCuCO3表示.实验室以废铜屑为原料制取碱式碳酸铜的步骤如下: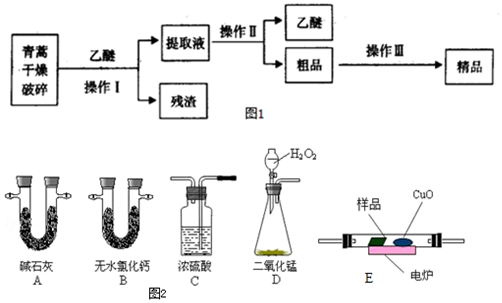
 (2)①用氨气制取尿素[CO(NH2)]的反应为:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△H<0.
(2)①用氨气制取尿素[CO(NH2)]的反应为:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△H<0.