题目内容
15.某兴趣小组甲设计了以下装置和方法测定空气中SO2含量.你认为可行的操作是B| 序号 | A | B | C |
| 装置 | 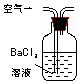 | 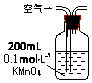 | 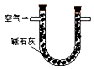 |
| 原理 | 通入V升空气,测定生成沉淀的质量 | 当KMnO4溶液刚好褪色时,测定通入空气的体积V | 通入V升空气,测定U型管增加的质量 |
分析 A.二氧化硫与氯化钡溶液不反应;
B.二氧化硫与KMnO4溶液反应,使溶液褪色;
C.空气中的二氧化硫、二氧化碳、水蒸气均能被碱石灰吸收.
解答 解:A.二氧化硫与氯化钡溶液不反应,把含有二氧化硫的空气通入氯化钡溶液中不能生成亚硫酸钡沉淀,所以不能求出二氧化硫的量,故A错误;
B.二氧化硫与KMnO4溶液反应,使溶液褪色,当KMnO4溶液刚好褪色时,二氧化硫与高锰酸钾恰好完全反应,根据消耗的高锰酸钾的物质的量可以求出二氧化硫的物质的量,进而能求出空气中SO2含量,故B正确;
C.空气中的二氧化硫、二氧化碳、水蒸气均能被碱石灰吸收,把含有二氧化硫的空气通过碱石灰,碱石灰增加的质量为二氧化硫、二氧化碳和水蒸气的质量和,所以不能求出二氧化硫的量,故C错误.
点评 本题考查了实验方案的评价、物质的性质实验探究,题目难度不大,注意把握二氧化硫、二氧化碳等物质的性质为解答该题的关键,学习中注意相关知识的积累.

练习册系列答案
相关题目
5.下列各组物质之间的化学反应,反应产物一定为纯净物的是( )
| A. | CH3-CH=CH-CH3+Br2$→_{△}^{催化剂}$ | |
| B. | CH2=CH-CH2CH3+HCl | |
| C. | CH3-CH=CH2+H2O $→_{加热、加压}^{催化剂}$ | |
| D. | CH3CH3+Cl2$\stackrel{光照}{→}$ |
3.向含Fe2+、I-、Br-的溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知b-a=5,线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素.下列说法正确的是( )
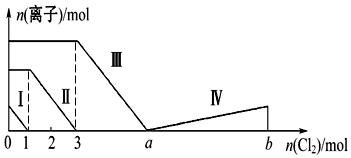

| A. | 线段Ⅱ表示Br-的变化情况 | B. | 原溶液中n(FeBr2):n(FeI2)=1:3 | ||
| C. | 线段Ⅳ表示IO3-的变化情况 | D. | 根据图象无法计算a的值 |
10.下列各选项中,正确的是( )
| A. | 实验室要配制0.lmol/LNaOH溶液400mL,需称取NaOH 固体1.6g | |
| B. | 焰火的五彩缤纷是某些金属元素化学性质的展现 | |
| C. | Al2O3熔点很高,可用作耐火材料 | |
| D. | 纯锌和铁相连接后,插入同一稀盐酸中,锌极上发生氧化还原反应 |
20.设NA为阿伏加德罗常数值.下列有关叙述正确的是( )
| A. | 1molN2与4molH2反应生成的NH3分子数为2NA | |
| B. | 14g乙烯和丙烯混合气体中的氢原子数为2NA | |
| C. | 1 molFe溶于过量硝酸,电子转移数为2NA | |
| D. | 标准状况下,2.24LCCl4含有的共价键数为0.4NA |
7.设一个碳12C的原子的质量为m g,一个R原子的质量为z g,阿伏伽德罗常数为NA,则R的相对原子质量可表示为( )
| A. | $\frac{z}{12m}$ | B. | $\frac{12z}{m}$ | C. | $\frac{{N}_{A}}{m}$ | D. | $\frac{{N}_{A}}{z}$ |
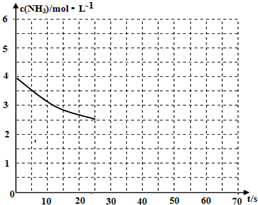 (2)①用氨气制取尿素[CO(NH2)]的反应为:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△H<0.
(2)①用氨气制取尿素[CO(NH2)]的反应为:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△H<0.