题目内容
硫代硫酸钠俗称大苏打、海波,是重要的工业原料.文献记录,硫代硫酸铺(Na2S2O3)溶液呈弱碱性,酸性环境中不稳定,发生S2O32-+2H+=SO2↑+S↓+H2O
【实验】:(1)某化学兴趣小组利用Na2S2O3探究外界因素对化学反应速率的影响.实验方案如下,设置了A、B、C三组实验.
①其中最先变浑浊的是 .(填序号)
②若A与B探究浓度对反应速率的影响,则上述表中V1= mL,理由是 .
(2)下列是某研究性小组对Na2S2O3的化学性质进一步探究.向Na2S2O3溶液中滴加少量新制氯水,氯水颜色很快褪去.
查阅文献知:
Ⅰ.Na2S2O3有还原性,可以被Cl2等强氧化剂氧化;
Ⅱ.少量Ag+可以与S2O2-3成白色沉淀,但充分振荡后会溶解;
Ⅲ.硫代硫酸钡易溶于水.
①甲同学向反应后的溶液中滴加少量硝酸银溶液,充分振荡后观察到有白色沉淀产生,并据此认为氯水可将Na2S2O3氧化.
你认为该方案是否合理,并说明理由 .
②请写出发生氧化还原反应使氯水褪色的离子反应方程式 .
③若你认为不合理,请你重新设计一个合理的实验方案,证明Na2S2O3和Cl2发生了氧化还原反应.(若认为合理,本题可以不做)
【问题与讨论】
(3)乙同学提出,若氯水可以氧化S2O2-3,那么硝酸也可以氧化S2O2-3.并推测若加入硝酸后溶液中不会出现沉淀,并在试管口可以看到红棕色气体生成.该同学向3%的硫代硫酸钠溶液中逐滴加入5%稀硝酸,发现立即有浑浊,并没有出现红棕色气体,直至加入较多的稀硝酸后才发现有红棕色气体生成.请你解释产生上述现象的原因 .
【实验】:(1)某化学兴趣小组利用Na2S2O3探究外界因素对化学反应速率的影响.实验方案如下,设置了A、B、C三组实验.
| 体积 | ||||
| 反应温度/℃ | 0.1mol?L-1Na2S2O3 | 0.1mol?L-1H2SO4 | H2O | |
| A | 10 | 10 | 10 | 0 |
| B | 10 | 9 | 10 | V1 |
| C | 50 | 8 | 10 | V2 |
②若A与B探究浓度对反应速率的影响,则上述表中V1=
(2)下列是某研究性小组对Na2S2O3的化学性质进一步探究.向Na2S2O3溶液中滴加少量新制氯水,氯水颜色很快褪去.
查阅文献知:
Ⅰ.Na2S2O3有还原性,可以被Cl2等强氧化剂氧化;
Ⅱ.少量Ag+可以与S2O2-3成白色沉淀,但充分振荡后会溶解;
Ⅲ.硫代硫酸钡易溶于水.
①甲同学向反应后的溶液中滴加少量硝酸银溶液,充分振荡后观察到有白色沉淀产生,并据此认为氯水可将Na2S2O3氧化.
你认为该方案是否合理,并说明理由
②请写出发生氧化还原反应使氯水褪色的离子反应方程式
③若你认为不合理,请你重新设计一个合理的实验方案,证明Na2S2O3和Cl2发生了氧化还原反应.(若认为合理,本题可以不做)
| 实验步骤 | 预期现象及结论 |
(3)乙同学提出,若氯水可以氧化S2O2-3,那么硝酸也可以氧化S2O2-3.并推测若加入硝酸后溶液中不会出现沉淀,并在试管口可以看到红棕色气体生成.该同学向3%的硫代硫酸钠溶液中逐滴加入5%稀硝酸,发现立即有浑浊,并没有出现红棕色气体,直至加入较多的稀硝酸后才发现有红棕色气体生成.请你解释产生上述现象的原因
考点:性质实验方案的设计,化学反应速率的影响因素
专题:
分析:(1)①表中给出的数据为浓度和温度的影响,一般来说,浓度越大,温度越高,反应速率越大,以此解答该题;
②根据控制变量法在研究反应速率的影响因素中的作用来回答;
(2)①根据氯气能和碱性物质反应的性质来回答;
②向Na2S2O3溶液中滴加少量新制氯水,氯气能将硫代硫酸根离子氧化,据此回答;
③根据硫酸根的检验的特征离子反应:可以和钡离子反应生成硫酸钡白色沉淀来回答;
(3)在酸性条件下,硝酸就表现氧化性,将硫代硫酸钠氧化为硫酸根离子,自身被还原为NO,接着被氧化为红棕色的二氧化氮,据此回答.
②根据控制变量法在研究反应速率的影响因素中的作用来回答;
(2)①根据氯气能和碱性物质反应的性质来回答;
②向Na2S2O3溶液中滴加少量新制氯水,氯气能将硫代硫酸根离子氧化,据此回答;
③根据硫酸根的检验的特征离子反应:可以和钡离子反应生成硫酸钡白色沉淀来回答;
(3)在酸性条件下,硝酸就表现氧化性,将硫代硫酸钠氧化为硫酸根离子,自身被还原为NO,接着被氧化为红棕色的二氧化氮,据此回答.
解答:
解:(1)①对于该反应来说浓度越大,温度越高,反应速率越大,表中C温度较高,则应大于A、B的反应速率即C反应速率较大,最先变浑浊,故选C;
②根据控制变量法在研究反应速率的影响因素中的作用,知道:若A与B探究浓度对反应速率的影响,则上述表中V1=1mL,保证混合液的体积一样的,理由是:混合液的体积一样,仅改变硫代硫酸钠的浓度,保持其他物质的浓度不变,
故答案为:1;混合液的体积一样,仅改变硫代硫酸钠的浓度,保持其他物质的浓度不变;
(2)①Na2S2O3溶液显示碱性,加入少量的氯水可能会发生反应:Cl2+2OH-=H2O+Cl-+ClO-,同样产生Cl-,滴加少量硝酸银溶液,充分振荡后观察到有白色沉淀产生,
故答案为:不合理,Na2S2O3溶液显示碱性,加入少量的氯水可能会发生反应:Cl2+2OH-=H2O+Cl-+ClO-同样产生Cl-;
②向Na2S2O3溶液中滴加少量新制氯水,发生的反应为:S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+,故答案为:S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+;
③硫酸根检验时要排除碳酸根离子和亚硫酸根离子的干扰,所以加入用盐酸酸化的氯化钡溶液,如果有白色沉淀产生,则证明含有硫酸根离子,反之则没有,
故答案为:取少量反应后的溶液.向其中滴入盐酸酸化的氯化钡溶液;若观察到有白色沉淀产生,则说明Na2S2O3能被氯水氧化;
(3)硝酸的氧化性在碱性环境下不会表现出来,向3%的硫代硫酸钠溶液中逐滴加入5%稀硝酸,碱性逐渐减弱,硫代硫酸钠会自身分解,出现浑浊,随着硝酸的加入,在酸性条件下,硝酸就表现氧化性,将硫代硫酸钠氧化为硫酸根离子,自身被还原为NO,接着被氧化为红棕色的二氧化氮,有红棕色气体生成,
故答案为:硝酸的氧化性在碱性环境下不会表现出来,向3%的硫代硫酸钠溶液中逐滴加入5%稀硝酸,碱性逐渐减弱,硫代硫酸钠会自身分解,一旦达到了酸性条件,硝酸就表现氧化性,将硫代硫酸钠氧化为硫酸根离子,自身被还原为NO,接着被氧化为红棕色的二氧化氮,有红棕色气体生成.
②根据控制变量法在研究反应速率的影响因素中的作用,知道:若A与B探究浓度对反应速率的影响,则上述表中V1=1mL,保证混合液的体积一样的,理由是:混合液的体积一样,仅改变硫代硫酸钠的浓度,保持其他物质的浓度不变,
故答案为:1;混合液的体积一样,仅改变硫代硫酸钠的浓度,保持其他物质的浓度不变;
(2)①Na2S2O3溶液显示碱性,加入少量的氯水可能会发生反应:Cl2+2OH-=H2O+Cl-+ClO-,同样产生Cl-,滴加少量硝酸银溶液,充分振荡后观察到有白色沉淀产生,
故答案为:不合理,Na2S2O3溶液显示碱性,加入少量的氯水可能会发生反应:Cl2+2OH-=H2O+Cl-+ClO-同样产生Cl-;
②向Na2S2O3溶液中滴加少量新制氯水,发生的反应为:S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+,故答案为:S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+;
③硫酸根检验时要排除碳酸根离子和亚硫酸根离子的干扰,所以加入用盐酸酸化的氯化钡溶液,如果有白色沉淀产生,则证明含有硫酸根离子,反之则没有,
故答案为:取少量反应后的溶液.向其中滴入盐酸酸化的氯化钡溶液;若观察到有白色沉淀产生,则说明Na2S2O3能被氯水氧化;
(3)硝酸的氧化性在碱性环境下不会表现出来,向3%的硫代硫酸钠溶液中逐滴加入5%稀硝酸,碱性逐渐减弱,硫代硫酸钠会自身分解,出现浑浊,随着硝酸的加入,在酸性条件下,硝酸就表现氧化性,将硫代硫酸钠氧化为硫酸根离子,自身被还原为NO,接着被氧化为红棕色的二氧化氮,有红棕色气体生成,
故答案为:硝酸的氧化性在碱性环境下不会表现出来,向3%的硫代硫酸钠溶液中逐滴加入5%稀硝酸,碱性逐渐减弱,硫代硫酸钠会自身分解,一旦达到了酸性条件,硝酸就表现氧化性,将硫代硫酸钠氧化为硫酸根离子,自身被还原为NO,接着被氧化为红棕色的二氧化氮,有红棕色气体生成.
点评:本题是一道性质实验方案的设计题,考查学生分析和解决问题的能力,难度大.

练习册系列答案
相关题目
据最新科技报道,科学家发现了新型氢粒子,这种粒子是由3个氢原子核(只含质子)和两个电子构成.对于这种氢粒子,下列说法中正确的是( )
| A、是氢的一种同素异形体 |
| B、是氢的一种新的同位素 |
| C、它的组成可用H3+表示 |
| D、它比一个普通H2分子多一个氢原子 |



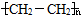 .
.