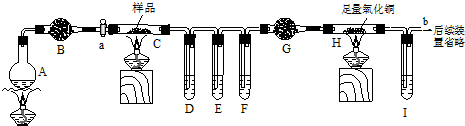
题目内容
硼镁泥是一种工业废料,主要成份是MgO(占40%),还有Al2O3、CaO、MnO、Fe2O3、FeO、SiO2等杂质,以此为原料提取硫酸镁晶体和氢氧化铝.
从硼镁泥中提取MgSO4?7H2O的流程如下:

已知:NaClO与Mn2+反应产生MnO2沉淀.
请完成下列填空:
(1)实验中需用1.00mol/L的硫酸80.0mL,若用98%的浓硫酸(密度1.84g/cm3)来配制,除玻璃棒、胶头滴管、烧杯外,还需要的定量玻璃仪器有 (注明规格).
(2)加入的NaClO有三个作用,用离子方程式表示其中一个作用: .
已知MgSO4、CaSO4的溶解度如下表:
(3)“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,操作步骤依次为蒸发浓缩、 .操作Ⅰ中的步骤之一是洗涤沉淀,具体的操作方法是 .
(4)如果测得提供的硼镁泥的质量为100.0g,得到的MgSO4?7H2O 196.8g,则MgSO4?7H2O的产率为 .
(5)从硼镁泥提取硫酸镁晶体后的滤渣,主要还含有Al(OH)3、Fe(OH)3,MnO2、SiO2,先用稀盐酸除去MnO2和SiO2,请补全下面的流程图,完成从滤渣中获取Al(OH)3的方案(仿照上述流程图表示).

从硼镁泥中提取MgSO4?7H2O的流程如下:

已知:NaClO与Mn2+反应产生MnO2沉淀.
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 2.3 | 4.0 | 7.6 |
| 完全沉淀pH | 4.1 | 5.2 | 9.6 |
(1)实验中需用1.00mol/L的硫酸80.0mL,若用98%的浓硫酸(密度1.84g/cm3)来配制,除玻璃棒、胶头滴管、烧杯外,还需要的定量玻璃仪器有
(2)加入的NaClO有三个作用,用离子方程式表示其中一个作用:
已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
(4)如果测得提供的硼镁泥的质量为100.0g,得到的MgSO4?7H2O 196.8g,则MgSO4?7H2O的产率为
(5)从硼镁泥提取硫酸镁晶体后的滤渣,主要还含有Al(OH)3、Fe(OH)3,MnO2、SiO2,先用稀盐酸除去MnO2和SiO2,请补全下面的流程图,完成从滤渣中获取Al(OH)3的方案(仿照上述流程图表示).

考点:制备实验方案的设计,物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:硼镁泥中加入稀硫酸,MgO、Al2O3、CaO、MnO、Fe2O3、FeO都和稀硫酸反应生成可溶性硫酸盐和水,向溶液中加入NaClO并调节溶液的pH在5~6之间,锰离子被次氯酸根离子氧化生成二氧化锰沉淀,亚铁离子被次氯酸根离子氧化生成铁离子,根据氢氧化物沉淀需要的pH知,铁离子和铝离子都生成沉淀,然后除钙,使钙离子和硫酸根离子生成硫酸钙沉淀,将混合溶液过滤得到滤液,最后将滤液蒸发浓缩、冷却结晶得到硫酸镁晶体;
(1)配制一定物质的量浓度的溶液需要容量瓶和量筒,根据配制溶液体积、浓硫酸体积选取容量瓶和量筒规格;
(2)次氯酸根离子具有强氧化性,能氧化还原性离子,亚硫酸根离子和氢离子反应生成次氯酸,从而增大溶液pH;
(3)从溶液中制取晶体采用加热浓缩、冷却结晶的方法;
(4)根据硼镁泥中镁的质量、硫酸镁晶体中镁的质量计算其产率;
(5)根据氢氧化铝、氢氧化铁、二氧化锰、二氧化硅的性质选取合适的溶剂,然后采用过滤的方法分离固体和溶液,再根据偏铝酸钠的性质制取氢氧化铝固体.
(1)配制一定物质的量浓度的溶液需要容量瓶和量筒,根据配制溶液体积、浓硫酸体积选取容量瓶和量筒规格;
(2)次氯酸根离子具有强氧化性,能氧化还原性离子,亚硫酸根离子和氢离子反应生成次氯酸,从而增大溶液pH;
(3)从溶液中制取晶体采用加热浓缩、冷却结晶的方法;
(4)根据硼镁泥中镁的质量、硫酸镁晶体中镁的质量计算其产率;
(5)根据氢氧化铝、氢氧化铁、二氧化锰、二氧化硅的性质选取合适的溶剂,然后采用过滤的方法分离固体和溶液,再根据偏铝酸钠的性质制取氢氧化铝固体.
解答:
解:硼镁泥中加入稀硫酸,MgO、Al2O3、CaO、MnO、Fe2O3、FeO都和稀硫酸反应生成可溶性硫酸盐和水,向溶液中加入NaClO并调节溶液的pH在5~6之间,锰离子被次氯酸根离子氧化生成二氧化锰沉淀,亚铁离子被次氯酸根离子氧化生成铁离子,根据氢氧化物沉淀需要的pH知,铁离子和铝离子都生成沉淀,然后除钙,使钙离子和硫酸根离子生成硫酸钙沉淀,将混合溶液过滤得到滤液,最后将滤液蒸发浓缩、冷却结晶得到硫酸镁晶体,
(1)实验中需用1.00mol/L的硫酸80.0mL,若用98%的浓硫酸(密度1.84g/cm3)来配制,浓硫酸的物质的量浓度=
mol/L=18.4mol/L,浓硫酸的体积=
=4.3mL,所以需要选取10mL量筒,则除玻璃棒、胶头滴管、烧杯外,还需要的定量玻璃仪器有100mL的容量瓶、10mL量筒,
故答案为:10mL量筒、100mL容量瓶;
(2)次氯酸根离子具有强氧化性,能将锰离子、亚铁离子氧化为二氧化锰沉淀、铁离子,从而除去杂质离子,次氯酸根离子和氢离子反应生成次氯酸,从而调节溶液的pH,离子方程式为ClO-+Mn2++H2O=2H++Cl-+MnO2↓、ClO-+2Fe2++2H+=Cl-+2Fe3++H2O、ClO-+H+?HClO,
故答案为:ClO-+Mn2++H2O=2H++Cl-+MnO2↓、ClO-+2Fe2++2H+=Cl-+2Fe3++H2O、ClO-+H+?HClO;
(3)操作步骤依次为蒸发浓缩、趁热过滤,因为温度越高硫酸钙、硫酸镁的溶解度越小,所以要趁热过滤;
洗涤沉淀的方法为向漏斗里加入蒸馏水,使水面没过沉淀物,等水流完后,重复操作数次,
故答案为:趁热过滤;向漏斗里加入蒸馏水,使水面没过沉淀物,等水流完后,重复操作数次;
(4)如果测得提供的硼镁泥的质量为100.0g,硼镁泥中Mg的质量=100.0g×40%×
=24g
得到的MgSO4?7H2O 196.8g,Mg的质量=196.8g×
×100%=19.2g,则MgSO4?7H2O的产率=
×100%=80.0%,
故答案为:80.0%;
(5)滤渣中Al(OH)3、Fe(OH)3和稀盐酸反应生成生成可溶性氯化物,MnO2、SiO2和HCl不反应,然后向溶液中加入过量NaOH溶液,铝离子转化为偏铝酸根离子,铁离子转化为氢氧化铁沉淀,然后过滤,向滤液中通入二氧化碳达到氢氧化铝沉淀,然后过滤得到沉淀,用蒸馏水洗涤沉淀、干燥沉淀即可得到氢氧化铝固体,其流程图为 ,
,
故答案为: .
.
(1)实验中需用1.00mol/L的硫酸80.0mL,若用98%的浓硫酸(密度1.84g/cm3)来配制,浓硫酸的物质的量浓度=
| 103×1.84×98% |
| 98 |
| 1.00mol/L×0.08L |
| 18.4mol/L |
故答案为:10mL量筒、100mL容量瓶;
(2)次氯酸根离子具有强氧化性,能将锰离子、亚铁离子氧化为二氧化锰沉淀、铁离子,从而除去杂质离子,次氯酸根离子和氢离子反应生成次氯酸,从而调节溶液的pH,离子方程式为ClO-+Mn2++H2O=2H++Cl-+MnO2↓、ClO-+2Fe2++2H+=Cl-+2Fe3++H2O、ClO-+H+?HClO,
故答案为:ClO-+Mn2++H2O=2H++Cl-+MnO2↓、ClO-+2Fe2++2H+=Cl-+2Fe3++H2O、ClO-+H+?HClO;
(3)操作步骤依次为蒸发浓缩、趁热过滤,因为温度越高硫酸钙、硫酸镁的溶解度越小,所以要趁热过滤;
洗涤沉淀的方法为向漏斗里加入蒸馏水,使水面没过沉淀物,等水流完后,重复操作数次,
故答案为:趁热过滤;向漏斗里加入蒸馏水,使水面没过沉淀物,等水流完后,重复操作数次;
(4)如果测得提供的硼镁泥的质量为100.0g,硼镁泥中Mg的质量=100.0g×40%×
| 24 |
| 40 |
得到的MgSO4?7H2O 196.8g,Mg的质量=196.8g×
| 24 |
| 246 |
| 19.2g |
| 24g |
故答案为:80.0%;
(5)滤渣中Al(OH)3、Fe(OH)3和稀盐酸反应生成生成可溶性氯化物,MnO2、SiO2和HCl不反应,然后向溶液中加入过量NaOH溶液,铝离子转化为偏铝酸根离子,铁离子转化为氢氧化铁沉淀,然后过滤,向滤液中通入二氧化碳达到氢氧化铝沉淀,然后过滤得到沉淀,用蒸馏水洗涤沉淀、干燥沉淀即可得到氢氧化铝固体,其流程图为
 ,
,故答案为:
 .
.
点评:本题考查制备实验方案设计,侧重考查学生综合应用能力,明确物质的性质是设计实验的依据,熟练掌握元素化合物知识,知道量筒、容量瓶规格的选取方法,题目难度中等.

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
下列说法中不正确的是( )
| A、σ键比π键的电子云重叠程度大,形成的共价键强 |
| B、C=C双键的键能是C-C单键键能的2倍 |
| C、s-s σ键与s-p σ键的电子云形状对称性相同 |
| D、N2分子中有一个σ键,2个π键 |
绿色化学对于化学反应提出了“原子经济性”(原子节约)的新概念及要求.理想的原子经济性反应是原料中的原子全部转变成所需产物,不产生副产物,实现零排放.下列几种生产乙苯( )的方法中,原子经济性最好的是(反应均在一定条件下进行)( )
)的方法中,原子经济性最好的是(反应均在一定条件下进行)( )
 )的方法中,原子经济性最好的是(反应均在一定条件下进行)( )
)的方法中,原子经济性最好的是(反应均在一定条件下进行)( )A、 +C2H5Cl→ +C2H5Cl→ +HCl +HCl |
B、 +C2H5OH→ +C2H5OH→ +H2O +H2O |
C、 +CH2═CH2→ +CH2═CH2→ |
D、 → → +HBr +HBr |
观察如图,下列叙述中错误的是( )
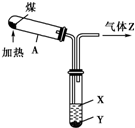

| A、图中操作发生了化学变化 |
| B、液体X的pH>7,液体Y是一种黑色黏稠状液体 |
| C、气体Z易燃,可还原CuO,但不能使溴水褪色 |
| D、试管A中得到的固体可用于工业炼铁、制粗硅等 |
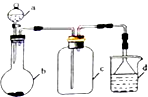 根据如图装置和表中提供的物质完成实验室制取、收集表中气体并进行尾气处理 (省略夹持、加热及净化装置),最合理的选项是( )
根据如图装置和表中提供的物质完成实验室制取、收集表中气体并进行尾气处理 (省略夹持、加热及净化装置),最合理的选项是( )