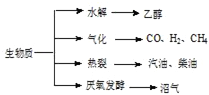
题目内容
化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
(1)在煤的气化反应器中发生如下几种反应:
C(s)十H2O(g)=CO(g)+H2(g)△H=+131kJ/mol
C(s)+O2(g)=CO2(g)△H=-394kJ/mol
CO(g)+
O2(g)=CO2(g)△H=-283kJ/mol
则CO(g)+H2O(g)?H2(g)+CO2(g)△H=
(2)已知830℃时,在一个容积固定的密闭容器中,发生反应CO(g)+H2O(g)?H2(g)+CO2(g)下列能判断该反应达到化学平衡状态的是
a.容器中的压强不变
b.1mol H-H键断裂的同时断裂2mol H-O键
c. V正(CO)=V逆 (H2O)
d.c(CO)=c(H2)
此温度下该反应的K=1,等物质的量的CO和H2O反应达平衡时,CO的转化率为
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?H2(g)+CO2(g),得到如下三组数据:
①实验1中以v(CO2)表示的反应速率为 .
②该反应的逆反应为 (填“吸”或“放’’)热反应
③若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t<3min,则a、b应满足的关系是 (用含a、b的数学式表示).
(4)目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:
3H2(g)+CO2(g)?CH3OH(g)+H2O(g),如图1,表示该反应进行过程中能量(单位为kJ/mol)的变化.

①在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,
下列措施中能使c(CH3OH)增大的是 (填字母)
a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1mol CO2和3molH2
②当反应达到平衡时不断改变条件(但不改变各组分物质的量和状态且只改变一个条件)反应速率随时间的变化.如图2:其中表示平衡混合物中CH3OH含量最高的一段时间是 ;如t0~t1平衡常数为K1,
t2~t3平衡常数为K2,则K1 K2(填>、=、<).
(1)在煤的气化反应器中发生如下几种反应:
C(s)十H2O(g)=CO(g)+H2(g)△H=+131kJ/mol
C(s)+O2(g)=CO2(g)△H=-394kJ/mol
CO(g)+
| 1 |
| 2 |
则CO(g)+H2O(g)?H2(g)+CO2(g)△H=
(2)已知830℃时,在一个容积固定的密闭容器中,发生反应CO(g)+H2O(g)?H2(g)+CO2(g)下列能判断该反应达到化学平衡状态的是
a.容器中的压强不变
b.1mol H-H键断裂的同时断裂2mol H-O键
c. V正(CO)=V逆 (H2O)
d.c(CO)=c(H2)
此温度下该反应的K=1,等物质的量的CO和H2O反应达平衡时,CO的转化率为
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?H2(g)+CO2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 0.4 | 3 |
| 3 | 900 | a | b | c | d | t |
②该反应的逆反应为
③若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t<3min,则a、b应满足的关系是
(4)目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:
3H2(g)+CO2(g)?CH3OH(g)+H2O(g),如图1,表示该反应进行过程中能量(单位为kJ/mol)的变化.

①在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,
下列措施中能使c(CH3OH)增大的是
a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1mol CO2和3molH2
②当反应达到平衡时不断改变条件(但不改变各组分物质的量和状态且只改变一个条件)反应速率随时间的变化.如图2:其中表示平衡混合物中CH3OH含量最高的一段时间是
t2~t3平衡常数为K2,则K1
考点:化学平衡的影响因素,热化学方程式,化学反应速率变化曲线及其应用
专题:化学平衡专题
分析:(1)根据盖斯定律计算焓变;
(2)当可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的质量、物质的量浓度及其百分含量不变;
根据化学平衡常数计算CO的转化率;
(3)①根据v(CO2)=
计算二氧化碳平均反应速率;
②因为压强不影响平衡移动,如果实验1、2转化率相等,则实验2达到平衡状态时氢气的物质的量应该是实验1的一半为0.8mol,实际上是0.4mol,说明升高温度平衡向逆反应方向移动,据此判断其反应热;
③若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t<3min,说明实验3反应速率大于实验2,压强不影响平衡移动,则实验3中a、b的物质的量之比等于实验2中水正确和CO的物质的量之比,或使用催化剂;
(4)①根据图象知,该反应的正反应是放热反应,能使c(CH3OH)增大,说明平衡向正反应方向移动;
②根据图象知,t1时刻,正逆反应速率都增大且可逆反应向逆反应方向移动,改变的条件是升高温度;t3时刻,正逆反应速率都增大且相等,改变的条件是加入催化剂;t4时刻正逆反应速率都减小,且平衡向逆反应方向移动,改变的条件是减小压强,据此分析解答.
(2)当可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的质量、物质的量浓度及其百分含量不变;
根据化学平衡常数计算CO的转化率;
(3)①根据v(CO2)=
| ||
| △t |
②因为压强不影响平衡移动,如果实验1、2转化率相等,则实验2达到平衡状态时氢气的物质的量应该是实验1的一半为0.8mol,实际上是0.4mol,说明升高温度平衡向逆反应方向移动,据此判断其反应热;
③若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t<3min,说明实验3反应速率大于实验2,压强不影响平衡移动,则实验3中a、b的物质的量之比等于实验2中水正确和CO的物质的量之比,或使用催化剂;
(4)①根据图象知,该反应的正反应是放热反应,能使c(CH3OH)增大,说明平衡向正反应方向移动;
②根据图象知,t1时刻,正逆反应速率都增大且可逆反应向逆反应方向移动,改变的条件是升高温度;t3时刻,正逆反应速率都增大且相等,改变的条件是加入催化剂;t4时刻正逆反应速率都减小,且平衡向逆反应方向移动,改变的条件是减小压强,据此分析解答.
解答:
解:(1)C(s)十H2O(g)=CO(g)+H2(g)△H=+131kJ/mol①
C(s)+O2(g)=CO2(g)△H=-394kJ/mol ②
CO(g)+
O2(g)=CO2(g)△H=-283kJ/mol ③
将方程式2③-②+①得CO(g)+H2O(g)?H2(g)+CO2(g)△H=2×(-283kJ/mol)-(-394kJ/mol)+(+131kJ/mol)=-41 kJ/mol,
故答案为:-41 kJ/mol;
(2)a.无论该反应是否达到平衡状态,容器中的压强始终不变,所以压强不能作为判断依据,故错误;
b.1mol H-H键断裂的同时断裂2mol H-O键,正逆反应速率相等,所以该反应达到平衡状态,故正确;
c. V正(CO)=V逆 (H2O)时,正逆反应速率相等,所以该反应达到平衡状态,故正确;
d.c(CO)=c(H2)时该反应不一定达到平衡状态,与反应初始浓度、转化率有关,所以不能据此判断平衡状态,故错误;
故选bc;
该温度下该反应的K=1,设等物质的量的CO和H2O的物质的量都是1mol,反应达平衡时,设CO的转化率为x,
CO(g)+H2O(g)?H2(g)+CO2(g)
开始1mol 1mol 0 0
反应xmol xmol xmol xmol
平衡(1-x)mol (1-x)mol xmol xmol
化学平衡常数K=
=1,x=0.5=50%,
故答案为:bc;50%;
(3)①v(CO2)=
=
=0.16 mol/(L.min),故答案为:0.16 mol/(L.min);
②因为压强不影响平衡移动,如果实验1、2转化率相等,则实验2达到平衡状态时氢气的物质的量应该是实验1的一半为0.8mol,实际上是0.4mol,说明升高温度平衡向逆反应方向移动,则逆反应是吸热反应,故答案为:吸;
③若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t<3min,说明实验3反应速率大于实验2,压强不影响平衡移动,则实验3中a、b的物质的量之比等于实验2中水正确和CO的物质的量之比=1:2,即b=2a,或使用催化剂也能实现目的,
故答案为:b=2a且a>l(或使用合适的催化剂);
(4)①根据图象知,该反应的正反应是放热反应,能使c(CH3OH)增大,说明平衡向正反应方向移动,
a.升高温度,平衡向逆反应方向移动,则c(CH3OH)减小,故错误;
b.充入He(g),使体系压强增大,但反应物、生成物浓度不变,平衡不移动,c(CH3OH)不变,故错误;
c.将H2O(g)从体系中分离出来,平衡向正反应方向移动,c(CH3OH)增大,故正确;
d.再充入1mol CO2和3molH2,平衡向正反应方向移动,c(CH3OH)增大,故正确;
故选cd;
②根据图象知,t1时刻,正逆反应速率都增大且可逆反应向逆反应方向移动,改变的条件是升高温度;t3时刻,正逆反应速率都增大且相等,改变的条件是加入催化剂;t4时刻正逆反应速率都减小,且平衡向逆反应方向移动,改变的条件是减小压强,所以平衡混合物中CH3OH含量最高的一段时间是t0~t1;如t0~t1平衡常数为K1,t2~t3平衡常数为K2,且t0~t1温度小于t2~t3温度,所以K1大于K2,故答案为:t0~t1;大于.
C(s)+O2(g)=CO2(g)△H=-394kJ/mol ②
CO(g)+
| 1 |
| 2 |
将方程式2③-②+①得CO(g)+H2O(g)?H2(g)+CO2(g)△H=2×(-283kJ/mol)-(-394kJ/mol)+(+131kJ/mol)=-41 kJ/mol,
故答案为:-41 kJ/mol;
(2)a.无论该反应是否达到平衡状态,容器中的压强始终不变,所以压强不能作为判断依据,故错误;
b.1mol H-H键断裂的同时断裂2mol H-O键,正逆反应速率相等,所以该反应达到平衡状态,故正确;
c. V正(CO)=V逆 (H2O)时,正逆反应速率相等,所以该反应达到平衡状态,故正确;
d.c(CO)=c(H2)时该反应不一定达到平衡状态,与反应初始浓度、转化率有关,所以不能据此判断平衡状态,故错误;
故选bc;
该温度下该反应的K=1,设等物质的量的CO和H2O的物质的量都是1mol,反应达平衡时,设CO的转化率为x,
CO(g)+H2O(g)?H2(g)+CO2(g)
开始1mol 1mol 0 0
反应xmol xmol xmol xmol
平衡(1-x)mol (1-x)mol xmol xmol
化学平衡常数K=
| x.x |
| (1-x)2 |
故答案为:bc;50%;
(3)①v(CO2)=
| ||
| △t |
| ||
| 5min |
②因为压强不影响平衡移动,如果实验1、2转化率相等,则实验2达到平衡状态时氢气的物质的量应该是实验1的一半为0.8mol,实际上是0.4mol,说明升高温度平衡向逆反应方向移动,则逆反应是吸热反应,故答案为:吸;
③若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t<3min,说明实验3反应速率大于实验2,压强不影响平衡移动,则实验3中a、b的物质的量之比等于实验2中水正确和CO的物质的量之比=1:2,即b=2a,或使用催化剂也能实现目的,
故答案为:b=2a且a>l(或使用合适的催化剂);
(4)①根据图象知,该反应的正反应是放热反应,能使c(CH3OH)增大,说明平衡向正反应方向移动,
a.升高温度,平衡向逆反应方向移动,则c(CH3OH)减小,故错误;
b.充入He(g),使体系压强增大,但反应物、生成物浓度不变,平衡不移动,c(CH3OH)不变,故错误;
c.将H2O(g)从体系中分离出来,平衡向正反应方向移动,c(CH3OH)增大,故正确;
d.再充入1mol CO2和3molH2,平衡向正反应方向移动,c(CH3OH)增大,故正确;
故选cd;
②根据图象知,t1时刻,正逆反应速率都增大且可逆反应向逆反应方向移动,改变的条件是升高温度;t3时刻,正逆反应速率都增大且相等,改变的条件是加入催化剂;t4时刻正逆反应速率都减小,且平衡向逆反应方向移动,改变的条件是减小压强,所以平衡混合物中CH3OH含量最高的一段时间是t0~t1;如t0~t1平衡常数为K1,t2~t3平衡常数为K2,且t0~t1温度小于t2~t3温度,所以K1大于K2,故答案为:t0~t1;大于.
点评:本题考查化学平衡的计算、热化学反应等知识点,侧重考查学生运用知识解答问题能力,难点是图象分析,知道外界条件改变对反应速率的影响,会正确判断平衡移动方向,注意:只有反应前后改变的物理量才能作为判断平衡状态的依据,难度中等.

练习册系列答案
相关题目
观察如图,下列叙述中错误的是( )
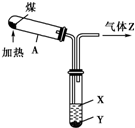

| A、图中操作发生了化学变化 |
| B、液体X的pH>7,液体Y是一种黑色黏稠状液体 |
| C、气体Z易燃,可还原CuO,但不能使溴水褪色 |
| D、试管A中得到的固体可用于工业炼铁、制粗硅等 |
下列有关生产生活涉及的操作和原理说法正确的是( )
| A、合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
| B、铁钉镀锌,将锌与电源负极相连,电镀过程需要控制电流强度、溶液pH等条件 |
| C、海轮外壳绑上锌板是采用牺牲阳极的阴极保护法,从而减缓钢铁腐蚀速率 |
| D、电解精炼铜时,阳极溶解铜的总质量和阴极析出铜的总质量相等 |

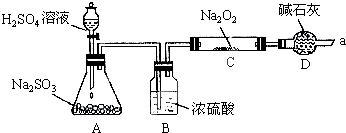
 得出结论:产物是Na2SO4,该方案是否合理
得出结论:产物是Na2SO4,该方案是否合理