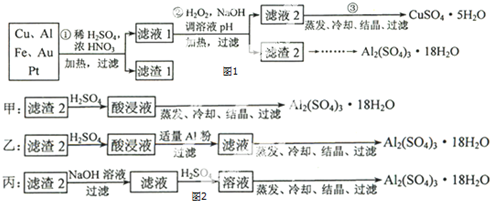
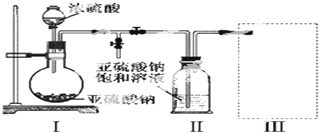
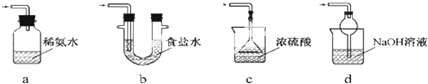
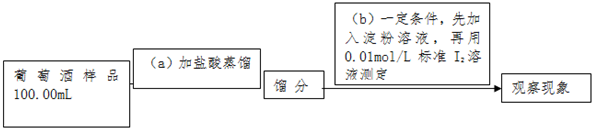
题目内容
6.在2A(g)+B(g)?3C(g)+4D(g)反应中,表示该反应速率最快的是( )| A. | v(A)=0.5 mol•L-1•s-1 | B. | v(B)=0.5 mol•L-1•s-1 | ||
| C. | v(C)=1.8 mol•L-1•min-1 | D. | v(D)=1 mol•L-1•s-1 |
分析 化学反应速率之比等于化学计量数之比,则反应速率与化学计量数的比值越大,反应速率越快,以此来解答.
解答 解:反应速率与化学计量数的比值越大,反应速率越快,则
A.$\frac{0.5}{2}$=0.25;
B.$\frac{0.5}{1}$=0.5;
C.$\frac{\frac{1.8}{60}}{3}$=0.01;
D.$\frac{1}{4}$=0.25,
显然B中比值最大,反应速率最快,
故选B.
点评 本题考查反应速率的比较,为高频考点,把握反应速率与化学计量数的关系为解答的关键,侧重分析与应用能力的考查,注意比值法的应用,反应速率单位要统一,题目难度不大.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
11.乙二醇是一种重要的工业防冻剂和合成高分子化合物的单体,实验室模拟生产乙二醇的过程:
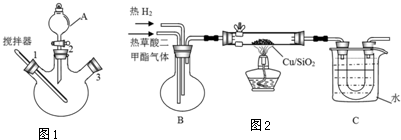
(一)草酸二甲酯的制备
实验室用图1所示装置模拟草酸二甲酯的制备:
步骤1:先往三颈烧瓶中加入甲醇,然后通过A在搅拌器工作时缓慢加入浓硫酸,混合液冷却后,再加入草酸;
步骤2:将A换为球形冷凝管,在3处塞上温度计,在一定的温度下回流2-3小时;
步骤3:将混合液冷凝分离得到草酸二甲酯.
(二)乙二醇的制取
实验室用图2所示的装置模拟工业乙二醇的制取(夹持设备和部分加热装置省略)
反应方程式为:
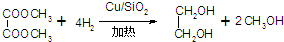
回答下列问题:
(1)仪器A的名称为分液漏斗,步骤3中首个操作是将混合物与冷水混合,则“混合”的正确操作是将混合物沿杯壁慢慢注入装有冷水的烧杯(或容器)中,并不断搅拌.
(2)装置B的作用是使草酸二甲酯和氢气混合均匀.烧杯C中水的温度不能低于55℃,原因是温度低于55℃,未反应的草酸二甲酯会凝结堵塞导管.
(3)对粗产品(主要含乙二醇、草酸二甲酯和甲醇)进行精制,蒸馏收集197.3℃(197℃左右即可)℃的馏分.
(4)实验过程中,使用了16g H2和59g草酸二甲酯,最后得到乙二醇为12.4g,乙二醇的产率为40%.
(5)设计实验证明乙二醇为二元醇:取62g乙二醇,加入足量金属钠充分反应,收集并测量生成的氢气的质量是2g(或其他合理答案,乙二醇与氢气的量符合正确比例即可).

| 物质 | 熔点 | 沸点 | 水溶性 | 相对分子质量 |
| 乙二醇 | -12.9℃ | 197.3℃ | 溶于水、醇 | 62 |
| 甲醇 | -97℃ | 64.7℃ | 与水互溶 | 32 |
| 草酸二甲酯 | 54℃ | 163.5℃ | 微熔于冷水,溶于醇和醚 | 118 |
实验室用图1所示装置模拟草酸二甲酯的制备:
步骤1:先往三颈烧瓶中加入甲醇,然后通过A在搅拌器工作时缓慢加入浓硫酸,混合液冷却后,再加入草酸;
步骤2:将A换为球形冷凝管,在3处塞上温度计,在一定的温度下回流2-3小时;
步骤3:将混合液冷凝分离得到草酸二甲酯.
(二)乙二醇的制取
实验室用图2所示的装置模拟工业乙二醇的制取(夹持设备和部分加热装置省略)
反应方程式为:
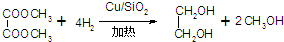
回答下列问题:
(1)仪器A的名称为分液漏斗,步骤3中首个操作是将混合物与冷水混合,则“混合”的正确操作是将混合物沿杯壁慢慢注入装有冷水的烧杯(或容器)中,并不断搅拌.
(2)装置B的作用是使草酸二甲酯和氢气混合均匀.烧杯C中水的温度不能低于55℃,原因是温度低于55℃,未反应的草酸二甲酯会凝结堵塞导管.
(3)对粗产品(主要含乙二醇、草酸二甲酯和甲醇)进行精制,蒸馏收集197.3℃(197℃左右即可)℃的馏分.
(4)实验过程中,使用了16g H2和59g草酸二甲酯,最后得到乙二醇为12.4g,乙二醇的产率为40%.
(5)设计实验证明乙二醇为二元醇:取62g乙二醇,加入足量金属钠充分反应,收集并测量生成的氢气的质量是2g(或其他合理答案,乙二醇与氢气的量符合正确比例即可).