题目内容
16.现有0.1mol N2和0.4mol H2的混合气体,在体积为2L的密闭容器中进行合成氨反应,平衡时压强是反应前压强的0.8倍,试计算:(1)平衡时NH3的浓度.
(2)平衡时混合气体的平均摩尔质量.
分析 发生3H2+N2?2NH3,设转化的氮气为xmol,则
3H2+N2?2NH3,
开始 0.4 0.1 0
转化 3x x 2x
平衡0.4-3x 0.1-x 2x
平衡时压强是反应前压强的0.8倍,则
$\frac{0.1-3x+0.4-x+2x}{0.1+0.4}$=0.8,
解得x=0.05mol,以此来解答.
解答 解:发生3H2+N2?2NH3,设转化的氮气为xmol,则
3H2+N2?2NH3,
开始 0.4 0.1 0
转化 3x x 2x
平衡0.4-3x 0.1-x 2x
平衡时压强是反应前压强的0.8倍,则
$\frac{0.1-3x+0.4-x+2x}{0.1+0.4}$=0.8,
解得x=0.05mol,
(1)平衡时NH3的浓度为$\frac{2×0.05mol}{2L}$=0.05mol/L,
答:平衡时NH3的浓度为0.05mol/L;
(2)平衡时混合气体的平均摩尔质量为$\frac{0.1mol×28g/mol+0.4mol×2g/mol}{0.5mol-2×0.05mol}$=9g/mol,
答:平衡时混合气体的平均摩尔质量为9g/mol.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、物质的量比等于压强比为解答的关键,侧重分析与计算能力的考查,注意平均摩尔质量的计算及质量守恒应用,题目难度不大.

练习册系列答案
相关题目
6.在2A(g)+B(g)?3C(g)+4D(g)反应中,表示该反应速率最快的是( )
| A. | v(A)=0.5 mol•L-1•s-1 | B. | v(B)=0.5 mol•L-1•s-1 | ||
| C. | v(C)=1.8 mol•L-1•min-1 | D. | v(D)=1 mol•L-1•s-1 |
4.在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)?zC(g),平衡时测得A的浓度为0.60mol/L,保持温度不变,将容器的体积扩大两倍,测得A的浓度变为0.35mol/L,下列有关判断正确的是( )
| A. | x+y<z | B. | 平衡正向移动 | C. | A的转化率降低 | D. | C的物质的量增大 |
1.下列有关化工生产的叙述中正确的是( )
| A. | 将煤液化、气化,有利于提高燃料的燃烧效率,减少污染物的排放 | |
| B. | 侯氏制碱法,向饱和NaCl溶液中先通入CO2再通入氨气制取纯碱 | |
| C. | 电解精炼铜时,同一时间内阳极溶解铜的质量与阴极析出铜的质量相等 | |
| D. | 工业生产硫酸时,建立高烟囱可以降低地面SO2的浓度,减少空气污染 |
6.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1mol甲基中含有的电子数为10NA | |
| B. | 22g CO2中含有共用电子对数4NA个 | |
| C. | 标准状况下22.4L氯仿(三氯甲烷)中共价键数目为4NA | |
| D. | 28g C2H4中含有2NA个碳原子 |
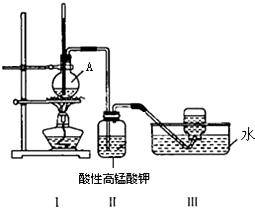 某学习小组在实验室里用乙醇与浓硫酸混合加热制乙烯,并进行有关乙烯性质的探究.装置如图.请帮助回答下列问题:
某学习小组在实验室里用乙醇与浓硫酸混合加热制乙烯,并进行有关乙烯性质的探究.装置如图.请帮助回答下列问题: