题目内容
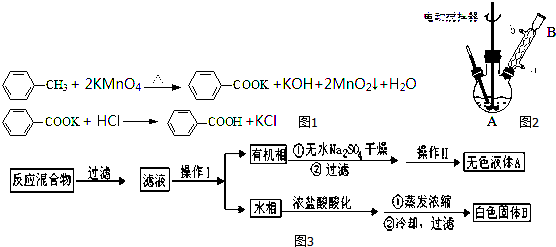
16.某实验小组模拟工业上用SiHC13与H2在1357K的条件下制备高纯硅,实验装置如下图所示(加热及夹持装置略去):
已知SiHC13的性质如下:沸点为33.0℃,密度为1.34g/mL,易溶于有机溶剂,能与H2O剧烈反应;在空气中易被氧化.请回答:
(1)组装好仪器后,应先进行的操作是检查装置的气密性.
(2)①装置B中的试剂是浓硫酸,②装置D中发生反应的化学方程式为SiHCl3+H2 $\frac{\underline{\;1357K\;}}{\;}$Si+3HCl.
(3)装置E中CCl4的作用为四氯化碳吸收未反应的SiHCl3、防止倒吸.
(4)相关实验步骤如下.其合理顺序为②①⑤④③(填序号).
①加热装置D至1357K;②打开K1,装置A中反应一段时间:③关闭K1;④关闭K2;⑤加热装置C,打开K2,滴加6.5mLSiHC13.
(5)计算SiHC13的利用率:对装置E中液体进行分液操作后,取上层液体20.00mL转移至锥形瓶中,滴加几滴酚酞溶液.用0.10mol/L盐酸滴定,达到滴定终点的现象是溶液变为无色,且半分钟内不出现红色,进行三次平行滴定,平均每次消耗盐酸20.00mL,则SiHC13的利用率为93.34%(保留两位小数).
分析 A装置制备氢气,B装置中盛放浓硫酸干燥氢气,防止SiHCl3水解,利用生成的氢气排尽装置内空气,防止安全事故的发生,再在D中反应得到高纯硅,同时生成HCl气体,D装置中四氯化碳吸收未反应的SiHCl3,氢氧化钠溶液吸收HCl,还可以防止倒吸,最后可以利用燃烧法处理氢气.
(1)组装好仪器后,实验室制备气体发生的反应,装置不能漏气;
(2)装置B中试剂是干燥氢气的干燥剂,可以选择浓硫酸,D中氢气与SiHCl3反应生成Si与HCl;
(3)吸收SiHCl3及HCl,并防止倒吸;
(4)先通入氢气,排尽装置中空气,再加热石英管,提高原理利用率,反应完毕停止通氢气;
(5)滴定终点时,氢氧化钠完全反应,溶液红色褪去;
氢氧化钠物质的量等于生成的HCl与后加入HCl的物质的量之和,可以计算生成HCl的物质的量,再根据方程式计算参加反应SiHCl3的质量,进而计算其利用率.
解答 解:A装置制备氢气,B装置中盛放浓硫酸干燥氢气,防止SiHCl3水解,利用生成的氢气排尽装置内空气,防止安全事故的发生,再在D中反应得到高纯硅,同时生成HCl气体,D装置中四氯化碳吸收未反应的SiHCl3,氢氧化钠溶液吸收HCl,还可以防止倒吸,最后可以利用燃烧法处理氢气.
(1)组装好仪器后,实验室制备气体发生的反应,应先进行的操作是检查装置的气密性,
故答案为:检查装置的气密性;
(2)①B装置中盛放浓硫酸干燥氢气,故答案为:浓硫酸;
②D中氢气与SiHCl3反应生成Si与HCl,反应方程式为:SiHCl3+H2 $\frac{\underline{\;1357K\;}}{\;}$Si+3HCl,
故答案为:SiHCl3+H2$\frac{\underline{\;1357K\;}}{\;}$ Si+3HCl;
(3)装置E的作用为:四氯化碳吸收未反应的SiHCl3,氢氧化钠溶液吸收HCl,还可以防止倒吸,
故答案为:四氯化碳吸收未反应的SiHCl3;防止倒吸;
(4)先通入氢气,排尽装置中空气,再加热石英管,提高原理利用率,反应完毕停止通氢气,②打开K1,装置A中反应一段时间,①加热装置D至1357K:;⑤加热装置C,打开K2,滴加6.5mLSiHC13;④关闭K2;③关闭K1,其合理顺序为:②①⑤④③,
故答案为:②①⑤④③;
(5)滴定终点时,氢氧化钠完全反应,溶液红色褪去,且半分钟不变色;
氢氧化钠物质的量等于生成的HCl与后加入HCl的物质的量之和,则生成HCl的物质的量=0.2L×1mol/L-0.02L×0.1mol/L×$\frac{200ml}{20ml}$=0.18mol,由SiHCl3+H2 $\frac{\underline{\;1357K\;}}{\;}$Si+3HCl,可知参加反应SiHCl3为 $\frac{0.18mol}{3}$=0.06mol,故SiHCl3的利用率为 $\frac{0.06mol×135.5g/mol}{6.5ml×1.34g/mol}$×100%=93.34%,
故答案为:溶液红色褪去,且半分钟不变色;93.34.
点评 本题考查物质制备实验方案设计,侧重考查学生获取信息和利用、基本操作能力,明确实验原理是解本题关键,题目难度中等.

| A. | 常温常压下,8gO2含有4NA个电子 | |
| B. | 任意条件下,16g O3所含的原子数为NA | |
| C. | 由CH4和C2H6组成的混合物中共有NA个分子,其中的氢原子数为5NA | |
| D. | 46 g二氧化氮和46 g四氧化二氮含有的原子数均是6NA |
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.009 | 0.008 | 0.008 | 0.008 |
(2)达到平衡时v(NO)为0.002mol/(L.s).
(3)能说明该反应已达到平衡状态的是be.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.NO、O2、NO2的浓度之比为2:1:2 d.容器内密度保持不变
e.容器内气体的颜色不再变化.
回答下列问题:
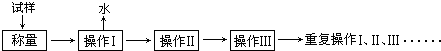
(1)以下是实验中可能用到的几种仪器,请在图下方横线上写出仪器名称.
a.
 电子天平 b.
电子天平 b. 坩埚 c.
坩埚 c.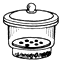 干燥器 d.
干燥器 d. 酒精喷灯
酒精喷灯①“操作I”是灼烧硫酸铜晶体,用到上述bd(填序号)仪器.
②“操作Ⅱ”的操作是冷却,必须在c(填序号)中进行.
(2)“重复操作Ⅰ、Ⅱ、Ⅲ”,称为恒重操作.
判断达到恒重的依据是相邻两次称量的质量差小于0.001g;
进行恒重操作的目的是确保晶体失去全部结晶水.
(3)某学生实验后得到以表数据:
| 加热前质量 | 加热后质量 | |
| m1(容器) | m2(容器+晶体) | m3(容器+无水硫酸铜) |
| 5.200g | 7.900g | 6.900g |
②该学生测定结果偏高(填“偏高”、“偏低”或“正确”).
③从下列分析中选出该学生产生实验误差的原因可能是(填序号)c.
a.没有进行恒重操作
b.加热固体到白色后,露置在空气中冷却
c.加热过程中晶体有少量溅失
d.加热后在干燥器中冷却至室温后称量.

请回答下列问题:
(1)煅烧前需将黄铁矿粉碎,其目的是充分燃烧,提高原料的利用率.
(2)煅烧造气过程中,若每生成1molSO2气体放出427.5kJ热量,煅烧反应的热化学反应方程式是4FeS2(s)+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3(s)+8SO2(g)△H=-3412kJ/mol.
(3)催化氧化是一个可逆反应,下表是不同条件下的SO2平衡的转化率:
| SO2的转化率% | 0.1MPa | 1MPa | 10MPa |
| 400°C | 99.2 | 99.7 | 99.9 |
| 600°C | 73.7 | 89.5 | 96.4 |
(4)吸收尾气过程常用NaOH溶液来吸收SO2,若在30L 0.1mol•L-1 的NaOH溶液中通入标准状况下44.8L SO2气体,其反应的离子方程式为3OH-+2SO2=SO32-+HSO3-+H2O,反应后的溶液pH<7,则溶液中离子浓度由大到小的顺序是c(Na+)>c(SO32-)>c(HSO3-)>c(H+)>c(OH-).
(5)另一种将SO2转化为硫酸的化工流程如图2.其中催化剂a表面的反应是SO2+2H2O-2e-═SO42-+4H+,该流程理论上参加反应的SO2与加入的H2O的质量比为8:15.
| A. | v(A)=0.5 mol•L-1•s-1 | B. | v(B)=0.5 mol•L-1•s-1 | ||
| C. | v(C)=1.8 mol•L-1•min-1 | D. | v(D)=1 mol•L-1•s-1 |
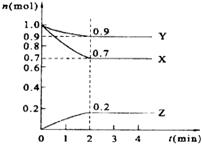 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.