题目内容
14.利用已经掌握的理论,解释下列事实.(1)焰火发出绚丽色彩的原理是:金属的焰色反应,灼烧时呈现不同的颜色
(2)请用核外电子排布的相关规则解释Fe3+较Fe2+(Fe3+不易再失电子)更稳定的原因:Fe3+的3d电子半满为稳定结构
(3)磷的第一电离能比硫的大的原因是:P的3p电子半满为稳定结构.
分析 (1)焰色反应时能呈现出来很多的色彩;
(2)Fe属于26号元素,Fe2+的核外有24个电子,则Fe2+的核外电子排布式为1s22s22p63s23p63d6,Fe3+的3d电子半满;
(3)P的核外电子排布式为1s22s22p63s23p3,S的核外电子排布式为1s22s22p63s23p4,3p电子半满为稳定结构.
解答 解:(1)焰火发出绚丽色彩的原理是:金属的焰色反应,灼烧时呈现不同的颜色,故答案为:金属的焰色反应,灼烧时呈现不同的颜色;
(2)用核外电子排布的相关规则解释Fe3+较Fe2+(Fe3+不易再失电子)更稳定的原因:Fe3+的3d电子半满为稳定结构,难失去电子,
故答案为:Fe3+的3d电子半满为稳定结构;
(3)磷的第一电离能比硫的大的原因是:P的3p电子半满为稳定结构,难失去电子,则第一电离能较大,
故答案为:P的3p电子半满为稳定结构.
点评 本题考查原子结构及元素的性质,为高频考点,把握半满为稳定结构为解答的关键,侧重分析与应用能力的考查,注意原子的核外电子排布,题目难度不大.

练习册系列答案
相关题目
4.在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
(1)写出该反应的平衡常数表达式:K=$\frac{{c}^{2}(N{O}_{2})^{\;}}{{c}^{2}(NO)c({O}_{2})}$.已知:K300°C>K350°C,则该反应是放热反应.
(2)达到平衡时v(NO)为0.002mol/(L.s).
(3)能说明该反应已达到平衡状态的是be.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.NO、O2、NO2的浓度之比为2:1:2 d.容器内密度保持不变
e.容器内气体的颜色不再变化.
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.009 | 0.008 | 0.008 | 0.008 |
(2)达到平衡时v(NO)为0.002mol/(L.s).
(3)能说明该反应已达到平衡状态的是be.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.NO、O2、NO2的浓度之比为2:1:2 d.容器内密度保持不变
e.容器内气体的颜色不再变化.
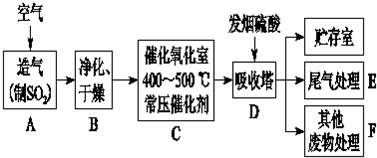
5.工业制硫酸的一种工艺流程如图1所示:

请回答下列问题:
(1)煅烧前需将黄铁矿粉碎,其目的是充分燃烧,提高原料的利用率.
(2)煅烧造气过程中,若每生成1molSO2气体放出427.5kJ热量,煅烧反应的热化学反应方程式是4FeS2(s)+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3(s)+8SO2(g)△H=-3412kJ/mol.
(3)催化氧化是一个可逆反应,下表是不同条件下的SO2平衡的转化率:
根据上表数据,你认为SO2的催化氧化反应实际生产过程中应选择的条件是温度在400°C左右、压强为1MPa.
(4)吸收尾气过程常用NaOH溶液来吸收SO2,若在30L 0.1mol•L-1 的NaOH溶液中通入标准状况下44.8L SO2气体,其反应的离子方程式为3OH-+2SO2=SO32-+HSO3-+H2O,反应后的溶液pH<7,则溶液中离子浓度由大到小的顺序是c(Na+)>c(SO32-)>c(HSO3-)>c(H+)>c(OH-).
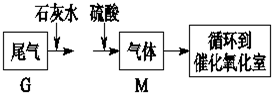
(5)另一种将SO2转化为硫酸的化工流程如图2.其中催化剂a表面的反应是SO2+2H2O-2e-═SO42-+4H+,该流程理论上参加反应的SO2与加入的H2O的质量比为8:15.

请回答下列问题:
(1)煅烧前需将黄铁矿粉碎,其目的是充分燃烧,提高原料的利用率.
(2)煅烧造气过程中,若每生成1molSO2气体放出427.5kJ热量,煅烧反应的热化学反应方程式是4FeS2(s)+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3(s)+8SO2(g)△H=-3412kJ/mol.
(3)催化氧化是一个可逆反应,下表是不同条件下的SO2平衡的转化率:
| SO2的转化率% | 0.1MPa | 1MPa | 10MPa |
| 400°C | 99.2 | 99.7 | 99.9 |
| 600°C | 73.7 | 89.5 | 96.4 |
(4)吸收尾气过程常用NaOH溶液来吸收SO2,若在30L 0.1mol•L-1 的NaOH溶液中通入标准状况下44.8L SO2气体,其反应的离子方程式为3OH-+2SO2=SO32-+HSO3-+H2O,反应后的溶液pH<7,则溶液中离子浓度由大到小的顺序是c(Na+)>c(SO32-)>c(HSO3-)>c(H+)>c(OH-).
(5)另一种将SO2转化为硫酸的化工流程如图2.其中催化剂a表面的反应是SO2+2H2O-2e-═SO42-+4H+,该流程理论上参加反应的SO2与加入的H2O的质量比为8:15.
6.在2A(g)+B(g)?3C(g)+4D(g)反应中,表示该反应速率最快的是( )
| A. | v(A)=0.5 mol•L-1•s-1 | B. | v(B)=0.5 mol•L-1•s-1 | ||
| C. | v(C)=1.8 mol•L-1•min-1 | D. | v(D)=1 mol•L-1•s-1 |
3.以下测定胆矾结晶水含量的操作中,正确的是( )
| A. | 加热、冷却、称量,重复两次即是恒重操作 | |
| B. | 瓷坩埚加热后冷却时,必须放在干燥器中 | |
| C. | 加热晶体时先用小火,后渐改为用大火加热 | |
| D. | 加热时如晶体爆溅出坩埚,应再加一些晶体 |
4.在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)?zC(g),平衡时测得A的浓度为0.60mol/L,保持温度不变,将容器的体积扩大两倍,测得A的浓度变为0.35mol/L,下列有关判断正确的是( )
| A. | x+y<z | B. | 平衡正向移动 | C. | A的转化率降低 | D. | C的物质的量增大 |
 实验室用NaBr、浓H2SO4、乙醇为原料,制备溴乙烷,反应的化学方程式为:
实验室用NaBr、浓H2SO4、乙醇为原料,制备溴乙烷,反应的化学方程式为: