题目内容
11.乙二醇是一种重要的工业防冻剂和合成高分子化合物的单体,实验室模拟生产乙二醇的过程: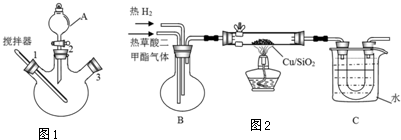
| 物质 | 熔点 | 沸点 | 水溶性 | 相对分子质量 |
| 乙二醇 | -12.9℃ | 197.3℃ | 溶于水、醇 | 62 |
| 甲醇 | -97℃ | 64.7℃ | 与水互溶 | 32 |
| 草酸二甲酯 | 54℃ | 163.5℃ | 微熔于冷水,溶于醇和醚 | 118 |
实验室用图1所示装置模拟草酸二甲酯的制备:
步骤1:先往三颈烧瓶中加入甲醇,然后通过A在搅拌器工作时缓慢加入浓硫酸,混合液冷却后,再加入草酸;
步骤2:将A换为球形冷凝管,在3处塞上温度计,在一定的温度下回流2-3小时;
步骤3:将混合液冷凝分离得到草酸二甲酯.
(二)乙二醇的制取
实验室用图2所示的装置模拟工业乙二醇的制取(夹持设备和部分加热装置省略)
反应方程式为:
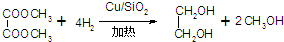
回答下列问题:
(1)仪器A的名称为分液漏斗,步骤3中首个操作是将混合物与冷水混合,则“混合”的正确操作是将混合物沿杯壁慢慢注入装有冷水的烧杯(或容器)中,并不断搅拌.
(2)装置B的作用是使草酸二甲酯和氢气混合均匀.烧杯C中水的温度不能低于55℃,原因是温度低于55℃,未反应的草酸二甲酯会凝结堵塞导管.
(3)对粗产品(主要含乙二醇、草酸二甲酯和甲醇)进行精制,蒸馏收集197.3℃(197℃左右即可)℃的馏分.
(4)实验过程中,使用了16g H2和59g草酸二甲酯,最后得到乙二醇为12.4g,乙二醇的产率为40%.
(5)设计实验证明乙二醇为二元醇:取62g乙二醇,加入足量金属钠充分反应,收集并测量生成的氢气的质量是2g(或其他合理答案,乙二醇与氢气的量符合正确比例即可).
分析 (1)A的名称是分液漏斗;混合时将混合物进入冷水中;
(2)B装置中草酸二甲酯气体和氢气能充分混合;草酸二甲酯的熔点是54℃,低于该温度时草酸二甲酯变为固态;
(3)乙二醇的沸点是197.3℃、甲醇的沸点是64.7℃、草酸二甲酯的沸点是163.5℃,要制得较纯净的乙二醇,温度应该在其沸点左右;
(4)n(H2)=$\frac{16g}{2g/mol}$=8mol,n(H3COOCCOOCH3)=$\frac{59g}{118g/mol}$=0.5mol,根据方程式知,0.5mol草酸二甲酯完全反应需要氢气2mol,所以氢气过量,如果草酸二甲酯完全反应生成乙二醇为0.5mol,其质量=0.5mol×62g/mol=31g,其产率=$\frac{实际产量}{理论产量}×100%$;
(5)醇羟基能和钠反应生成醇钠和氢气,可以利用乙二醇和钠反应生成氢气确定乙二醇是二元醇.
解答 解:(1)A的名称是分液漏斗;混合时将混合物沿杯壁慢慢注入装有冷水的烧杯(或容器)中,并不断搅拌,故答案为:分液漏斗;将混合物沿杯壁慢慢注入装有冷水的烧杯(或容器)中,并不断搅拌;
(2)B装置中草酸二甲酯气体和氢气能充分混合,更有利于反应向右进行;草酸二甲酯的熔点是54℃,低于该温度时草酸二甲酯变为固态,导致堵塞导管而产生安全事故,
故答案为:使草酸二甲酯和氢气混合均匀;温度低于55℃,未反应的草酸二甲酯会凝结堵塞导管;
(3)乙二醇的沸点是197.3℃、甲醇的沸点是64.7℃、草酸二甲酯的沸点是163.5℃,要制得较纯净的乙二醇,温度应该在其沸点左右,为197.3℃(197℃左右即可),
古答案为:197.3℃(197℃左右即可);
(4)n(H2)=$\frac{16g}{2g/mol}$=8mol,n(H3COOCCOOCH3)=$\frac{59g}{118g/mol}$=0.5mol,根据方程式知,0.5mol草酸二甲酯完全反应需要氢气2mol,所以氢气过量,如果草酸二甲酯完全反应生成乙二醇为0.5mol,其质量=0.5mol×62g/mol=31g,其产率=$\frac{实际产量}{理论产量}×100%$=$\frac{12.4g}{31g}$×100%=40%,
故答案为:40%;
(5)醇羟基能和钠反应生成醇钠和氢气,可以利用乙二醇和钠反应生成氢气确定乙二醇是二元醇,其检验方法为取62g乙二醇,加入足量金属钠充分反应,收集并测量生成的氢气的质量是2g(或其他合理答案,乙二醇与氢气的量符合正确比例即可),
故答案为:取62g乙二醇,加入足量金属钠充分反应,收集并测量生成的氢气的质量是2g(或其他合理答案,乙二醇与氢气的量符合正确比例即可).
点评 本题考查物质制备,为高频考点,涉及官能团个数的检验、方程式计算、物质分离和提纯等知识点,把握化学反应原理、物质性质差异性是解本题关键,难点是实验方案设计(5)题,侧重考查学生知识综合运用及实验操作能力,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
回答下列问题:
(1)以下是实验中可能用到的几种仪器,请在图下方横线上写出仪器名称.
a.
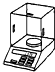 电子天平 b.
电子天平 b.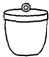 坩埚 c.
坩埚 c.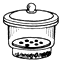 干燥器 d.
干燥器 d.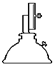 酒精喷灯
酒精喷灯①“操作I”是灼烧硫酸铜晶体,用到上述bd(填序号)仪器.
②“操作Ⅱ”的操作是冷却,必须在c(填序号)中进行.
(2)“重复操作Ⅰ、Ⅱ、Ⅲ”,称为恒重操作.
判断达到恒重的依据是相邻两次称量的质量差小于0.001g;
进行恒重操作的目的是确保晶体失去全部结晶水.
(3)某学生实验后得到以表数据:
| 加热前质量 | 加热后质量 | |
| m1(容器) | m2(容器+晶体) | m3(容器+无水硫酸铜) |
| 5.200g | 7.900g | 6.900g |
②该学生测定结果偏高(填“偏高”、“偏低”或“正确”).
③从下列分析中选出该学生产生实验误差的原因可能是(填序号)c.
a.没有进行恒重操作
b.加热固体到白色后,露置在空气中冷却
c.加热过程中晶体有少量溅失
d.加热后在干燥器中冷却至室温后称量.
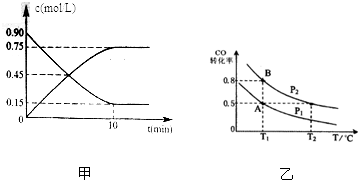
| A. | v(A)=0.5 mol•L-1•s-1 | B. | v(B)=0.5 mol•L-1•s-1 | ||
| C. | v(C)=1.8 mol•L-1•min-1 | D. | v(D)=1 mol•L-1•s-1 |

I.根据上图回答:
(1)步骤1中加入Na2CO3溶液的作用洗涤铁屑表面的油污.结合离子方程式简要说明步骤1中加热的原因CO32-+H2O?HCO3-+OH-,加热促进CO32-的水解,增大OH-浓度.
(2)制得的晶体过滤后用无水乙醇洗涤而不用蒸馏水,理由是摩尔盐易溶于水而难溶于乙醇.
Ⅱ.制摩尔盐的原料之一是硫酸铵,评价硫酸铵化肥的主要指标如下:
| 优等品 | 一等品 | 合格品 | |
| 外观 | 白色结晶,无可见机械杂质 | 无可见机械杂质 | |
| 氮(N)含量 | ≥21.0% | ≥21.0% | ≥20.5% |

【观察外观】该硫酸铵化肥无可见机械杂质.
【实验探究】按图示装置进行实验.
【交流讨论】
(1)甲同学:根据此实验测得的数据,计算的硫酸铵化肥的含氮量偏高(填偏高、偏低、或不影响),实验装置中存在一个明显缺陷是缺少干燥装置.
(2)乙同学:实验过程中,往烧瓶中加入的浓氢氧化钠溶液一定要足量并充分加热,原因是NH4++OH-═NH3↑+H2O,使得NH4+全部转化为NH3,最终进入B装置被吸收.
【探究结论】
(3)称取27.0g硫酸铵化肥样品,用改进后的实验装置重新进行实验,测得实验后B装置增重6.8g.则该化肥含氮量为20.7%,由此可判断该化肥的品质.
| A. | 加热、冷却、称量,重复两次即是恒重操作 | |
| B. | 瓷坩埚加热后冷却时,必须放在干燥器中 | |
| C. | 加热晶体时先用小火,后渐改为用大火加热 | |
| D. | 加热时如晶体爆溅出坩埚,应再加一些晶体 |
| A. | 目前科学家已经制得单原子层锗,其电子迁移率是硅的10倍,有望取代硅用于制造更好的晶体管 | |
| B. | 高锰酸钾溶液、酒精、过氧化钠都能杀菌消毒,消毒原理相同,都利用了强氧化性 | |
| C. | “加碘食盐”、“含氟牙膏”、“富硒营养品”、“高钙牛奶”、“加铁酱油”等等,这里的碘、氟、硒指的是对应的单质分子,而钙、铁则指的是对应的钙离子和铁离子 | |
| D. | PM2.5是指大气中直径接近2.5微米的颗粒物,入肺影响健康,这种颗粒物分散空气中形成胶体,它具有丁达尔现象 |
| A. | 将煤液化、气化,有利于提高燃料的燃烧效率,减少污染物的排放 | |
| B. | 侯氏制碱法,向饱和NaCl溶液中先通入CO2再通入氨气制取纯碱 | |
| C. | 电解精炼铜时,同一时间内阳极溶解铜的质量与阴极析出铜的质量相等 | |
| D. | 工业生产硫酸时,建立高烟囱可以降低地面SO2的浓度,减少空气污染 |