题目内容
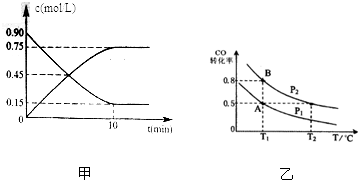
17.已知一氧化碳与水蒸气的反应为:CO(g)+H2O(g)?CO2(g)+H2(g).在某温度下,平衡常数是9.如果反应开始时,一氧化碳和水蒸气的浓度都是0.01mol/L,经10min反应达到平衡.计算:
(1)从反应开始至达到平衡时CO的反应速率为7.5×10-4mol•L-1•min-1.
(2)达到平衡时一氧化碳的转化率为75%;
(3)在恒温恒容的条件下,向上述平衡体系中再充入等物质的量之比的CO(g)和H2O(g)重新达到平衡时,H2的体积百分数为37.5%.
分析 设一氧化碳的浓度变化量为xmol/L,则:
CO(g)+H2O(g)?H2(g)+CO2(g)
起始量(mol/L):0.01 0.01 0 0
变化量(mol/L):x x x x
平衡量(mol/L):0.01-x 0.01-x x x
再根据平衡常数K=$\frac{c({H}_{2})×c(C{O}_{2})}{c(CO)×c({H}_{2}O)}$=9可计算x,进而计算各物质的反应速率、转化率等,以此解答该题.
解答 解:设一氧化碳的浓度变化量为xmol/L,则:
CO(g)+H2O(g)?H2(g)+CO2(g)
起始量(mol/L):0.01 0.01 0 0
变化量(mol/L):x x x x
平衡量(mol/L):0.01-x 0.01-x x x
则K=$\frac{c({H}_{2})×c(C{O}_{2})}{c(CO)×c({H}_{2}O)}$=$\frac{x×x}{(0.01-x)×(0.01-x)}$=9,解得:x=0.0075,
(1)从反应开始至达到平衡时CO的反应速率为$\frac{0.0075mol/L}{10min}$=7.5×10-4mol•L-1•min-1,故答案为:7.5×10-4;
(2)CO转化率=$\frac{0.0075mol/L}{0.01mol/L}$×100%=75%,
故答案为:75%;
(3)因反应前后气体的体积相等,则增大压强平衡不移动,在恒温恒容的条件下,向上述平衡体系中再充入等物质的量之比的CO(g)和H2O(g)重新达到平衡时,H2的体积百分数不变,为$\frac{0.0075}{0.02}×100%$=37.5%.
故答案为:37.5%.
点评 本题考查化学平衡有关计算,为高考常见题型,侧重于学生的分析能力和计算能力的考查,题目比较基础,注意三段式在化学平衡计算中应用,掌握化学平衡常数的用途:1、判断反应进行的程度,2、判断反应的热效应,3、判断反应进行的方向,4、计算转化率等.

 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案
请回答下列问题:
(1)煅烧前需将黄铁矿粉碎,其目的是充分燃烧,提高原料的利用率.
(2)煅烧造气过程中,若每生成1molSO2气体放出427.5kJ热量,煅烧反应的热化学反应方程式是4FeS2(s)+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3(s)+8SO2(g)△H=-3412kJ/mol.
(3)催化氧化是一个可逆反应,下表是不同条件下的SO2平衡的转化率:
| SO2的转化率% | 0.1MPa | 1MPa | 10MPa |
| 400°C | 99.2 | 99.7 | 99.9 |
| 600°C | 73.7 | 89.5 | 96.4 |
(4)吸收尾气过程常用NaOH溶液来吸收SO2,若在30L 0.1mol•L-1 的NaOH溶液中通入标准状况下44.8L SO2气体,其反应的离子方程式为3OH-+2SO2=SO32-+HSO3-+H2O,反应后的溶液pH<7,则溶液中离子浓度由大到小的顺序是c(Na+)>c(SO32-)>c(HSO3-)>c(H+)>c(OH-).
(5)另一种将SO2转化为硫酸的化工流程如图2.其中催化剂a表面的反应是SO2+2H2O-2e-═SO42-+4H+,该流程理论上参加反应的SO2与加入的H2O的质量比为8:15.
| A. | v(A)=0.5 mol•L-1•s-1 | B. | v(B)=0.5 mol•L-1•s-1 | ||
| C. | v(C)=1.8 mol•L-1•min-1 | D. | v(D)=1 mol•L-1•s-1 |
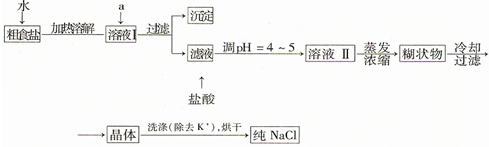
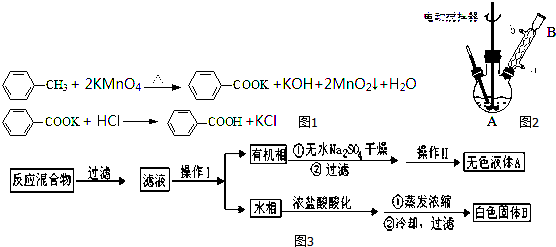

 实验室用NaBr、浓H2SO4、乙醇为原料,制备溴乙烷,反应的化学方程式为:
实验室用NaBr、浓H2SO4、乙醇为原料,制备溴乙烷,反应的化学方程式为: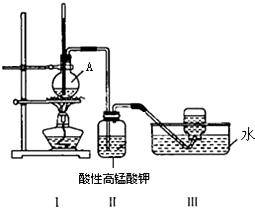 某学习小组在实验室里用乙醇与浓硫酸混合加热制乙烯,并进行有关乙烯性质的探究.装置如图.请帮助回答下列问题:
某学习小组在实验室里用乙醇与浓硫酸混合加热制乙烯,并进行有关乙烯性质的探究.装置如图.请帮助回答下列问题: