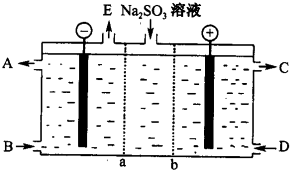
题目内容
18.Na2CO3和NaHCO3的混合物2.74g溶于水配成100mL溶液,其中c(Na+)=0.4mol•L-1,求:(1)溶液中Na+的物质的量是多少?
(2)加热灼烧后剩余固体的质量是多少?
分析 (1)结合n=cV计算;
(2)设Na2CO3和NaHCO3的物质的量分别为x、y,则
$\left\{\begin{array}{l}{2x+y=0.1L×0.4mol/L}\\{106x+84y=2.74}\end{array}\right.$,
解得x=0.01mol,y=0.02mol,
加热灼烧后剩余固体为碳酸钠,以此来解答.
解答 解:(1)n(Na+)=100mL×10-3 L•mL-1×0.4mol•L-1=0.04mol,
答:溶液中Na+的物质的量是0.04mol;
(2)设Na2CO3和NaHCO3的物质的量分别为x、y,则
$\left\{\begin{array}{l}{2x+y=0.1L×0.4mol/L}\\{106x+84y=2.74}\end{array}\right.$,
解得x=0.01mol,y=0.02mol,
即n(Na2CO3)=0.01mol、n(NaHCO3)=0.02mol,
加热灼烧后剩余固体为碳酸钠,
灼烧后剩余Na2CO3为0.01mol+0.01mol=0.02mol,
m=0.02mol×106g/mol=2.12g,
答:加热灼烧后剩余固体的质量是2.12g.
点评 本题考查混合物的计算,为高频考点,把握质量关系、物质的量计算公式为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
9.用0.1000mol•L-1标准NaOH溶液测定食醋中醋酸的含量,下列说法正确的是( )
| A. | 酸式滴定管、碱式滴定管及锥形瓶均需洗净后再润洗内壁2~3次 | |
| B. | 应该选择酚酞作指示剂 | |
| C. | 滴定过程中眼睛应始终注视滴定管内液面变化 | |
| D. | 读取标准液的刻度时,滴定前平视,滴定后仰视,测定结果偏低 |
13.下面叙述正确的是( )
| A. | 蔗糖遇浓硫酸可发生碳化现象,但与稀硫酸则不会发生反应 | |
| B. | 因为纤维素结构中有羟基,所以它能与醋酸发生酯化反应,生成乙酸纤维素酯 | |
| C. | 除去淀粉中的葡萄糖杂质,可用加水渗析的方法 | |
| D. | 将淀粉与水在酸作用下加热水解,在滴入碘酒不变蓝时表示水解完全,即可停止加热 |
3.关于下列各图的叙述,正确的是( )
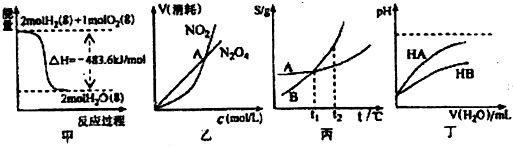

| A. | 甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6kJ•mol-l | |
| B. | 乙表示恒温恒容条件下发生的可逆反应2NO2?N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 | |
| C. | 丙表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数B=A | |
| D. | 丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH大于NaB溶液 |
8.下列气体不能用排气法收集的是( )
| A. | Cl2 | B. | CO2 | C. | NH3 | D. | NO |