题目内容
10.下列说法正确的是( )| A. | 分子式为C6H14O的醚有15种 | |
| B. | 将气体通过酸性高锰酸钾溶液可提纯含有乙烯杂质的乙烷 | |
| C. | 分馏、干馏都属于物理变化,裂化、裂解都属于化学变化 | |
| D. | 聚乙烯、橡胶、聚酯纤维都是通过加聚反应制得的高分子化合物 |
分析 A.C6H14的同分异构体有:①CH3CH2CH2CH2CH2CH3、②CH3CH2CH2CH(CH3)2、③CH3CH2CH(CH3)CH2CH3、④CH3CH2C(CH3)3、⑤CH(CH3)2CH(CH3)2,在C与C之间插入O形成醚,结合对称性判断;
B.乙烯被高锰酸钾氧化生成二氧化碳;
C.分馏与混合物的沸点有关,而干馏生成煤焦油等,裂化、裂解均由大分子生成小分子;
D.聚酯纤维含-COOC-,由缩聚反应生成.
解答 解:A.C6H14的同分异构体有:①CH3CH2CH2CH2CH2CH3、②CH3CH2CH2CH(CH3)2、③CH3CH2CH(CH3)CH2CH3、④CH3CH2C(CH3)3、⑤CH(CH3)2CH(CH3)2,在C与C之间插入O形成醚,由对称性可知,①可形成3种醚,②可形成4种醚,③可形成3种醚,④可形成3种醚,⑤可形成2种醚,共15种,故A正确;
B.乙烯被高锰酸钾氧化生成二氧化碳,引入新杂质,应选溴水、洗气,故B错误;
C.分馏与混合物的沸点有关,而干馏生成煤焦油等,裂化、裂解均由大分子生成小分子,则分馏为物理变化,干馏、裂化、裂解都属于化学变化,故C错误;
D.聚酯纤维含-COOC-,由缩聚反应生成,而聚乙烯、橡胶都是通过加聚反应制得的高分子化合物,故D错误;
故选A.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物的结构、官能团与性质、有机反应为解答的关键,侧重分析与应用能力的考查,注意选项A为解答的难点,题目难度不大.

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案
相关题目
16.W、X、Y、Z为原子序数依次增大的短周期元素,X、Y、Z同周期且相邻.由上述四种元素组成的化合物分解生成三种产物,其中两种气体产物的水溶液酸碱性相反.下列说法正确的是( )
| A. | 原子半径:W<X<Y<Z | |
| B. | 最高价氧化物对应水化物酸性:X>Y | |
| C. | W、X两种元素组成的化合物难溶于水 | |
| D. | W、Y、Z三种元素不能组成离子化合物 |
1.已知An+、B(n+1)+、Cn-、D(n+1)-具有相同的电子层结构.下列关于A、B、C、D四种元素的叙述中正确的是( )
| A. | 气态氢化物的稳定性:D>C | |
| B. | 原子序数:B>A>C>D | |
| C. | 最高价氧化物对应水化物的碱性:B>A | |
| D. | 四种元素一定都属于短周期元素 |
5.某化学研究性学习小组用CO还原Fe2O3,并在实验结束后用磁铁吸出生成的黑色粉末X进行探究.
[探究目的]分析黑色粉末X的组成,并进行相关实验.
[查阅资料]
I.CO还原Fe2O3的实验中若温度不同、受热不均时会生成Fe3O4,也能被磁铁吸引.
II.Fe3O4+8H+=2Fe3++Fe2++4H2O
[猜想假设]黑色粉末X的组成可能是Fe、Fe3O4,或二者的混合物.
[实验探究]
(1)实验①中产生气泡的离子方程式为Fe+2H+═Fe2++H2↑.
(2)根据②中溶液未呈红色,不能推断出黑色粉末X中无Fe3O4,请用离子方程式解释原因:Fe3O4+8H+═2Fe3++Fe2++4H2O、Fe+2Fe3+═3Fe2+.
(3)为了证明黑色粉末X中是否含有Fe3O4,该小组进行如图所示实验:

请根据数据分析说明黑色粉末X中是否含有Fe3O4.方法1:因为32gFe2O3中含Fe元素为22.4g,而25.6g>22.4g,所以X中还含有O元素,还含有Fe3O4;
方法2:因为产生产生4.48L氢气,需要Fe单质为11.2g,而25.6g>11.2g,所以X中还含有Fe3O4.
[探究目的]分析黑色粉末X的组成,并进行相关实验.
[查阅资料]
I.CO还原Fe2O3的实验中若温度不同、受热不均时会生成Fe3O4,也能被磁铁吸引.
II.Fe3O4+8H+=2Fe3++Fe2++4H2O
[猜想假设]黑色粉末X的组成可能是Fe、Fe3O4,或二者的混合物.
[实验探究]
| 编号 | 实验操作 | 实验现象 |
| ① | 取少量黑色粉末X放入试管中,注入足量的一定浓度的盐酸,微热 | 黑色粉末逐渐溶解,同时有气泡产生,溶液呈浅绿色. |
| ② | 向上述试管中滴加几滴KSCN溶液,振荡 | 溶液没有呈现红色 |
(2)根据②中溶液未呈红色,不能推断出黑色粉末X中无Fe3O4,请用离子方程式解释原因:Fe3O4+8H+═2Fe3++Fe2++4H2O、Fe+2Fe3+═3Fe2+.
(3)为了证明黑色粉末X中是否含有Fe3O4,该小组进行如图所示实验:

请根据数据分析说明黑色粉末X中是否含有Fe3O4.方法1:因为32gFe2O3中含Fe元素为22.4g,而25.6g>22.4g,所以X中还含有O元素,还含有Fe3O4;
方法2:因为产生产生4.48L氢气,需要Fe单质为11.2g,而25.6g>11.2g,所以X中还含有Fe3O4.
15.柠檬酸是常见的食品添加剂,其结构式如图所示.以下叙述正确的是( )


| A. | 柠檬酸分子式为C6H9O7 | |
| B. | 使用食品添加剂属于违法行为 | |
| C. | 柠檬酸可用作食品抗氧化剂,说明其有较强氧化性 | |
| D. | 柠檬酸分子含三个羧基(-COOH) |
2.NH3作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的 催化剂研究催化剂常具有较强的选择性,即专一性.已知:
反应 I:4NH3(g)+5O2(g)$\stackrel{PtRu}{?}$4NO(g)+6H2O(g)△H=-905.0kJ•mol-1
反应 II:4NH3(g)+3O2(g)$?_{高温}^{CU/TiO_{2}}$2N2(g)+6H2O(g)△H
(1)
△H=-1260KJ/mol.
(2)在恒温恒容装置中充入一定量的 NH3 和 O2,在某催化剂的作用下进行反应 I,则下 列有关叙述中正确的是A.
A.使用催化剂时,可降低该反应的活化能,加快其反应速率
B.若测得容器内 4v 正(NH3)=6v 逆(H2O)时,说明反应已达平衡
C.当容器内 $\frac{n(NO)}{n(N{H}_{3})}$=1 时,说明反应已达平衡
(3)氨催化氧化时会发生上述两个竞争反应 I、II.为分析某催化剂对该反应的选择性,在 1L 密闭容器中充入 1mol NH3和 2mol O2,测得有关物质的量关系如图:
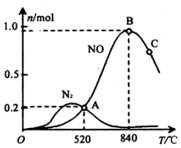
①该催化剂在高温时选择反应I(填“I”或“II”).
②520℃时,4NH3(g)+5O2?4NO(g)+6H2O(g)的平衡常数K=$\frac{0.{2}^{4}×0.{9}^{6}}{0.{4}^{4}×1.4{5}^{5}}$(不要求得出计算结果,只需列出数字计算式).
③有利于提高 NH3 转化为 N2 平衡转化率的措施有E
A.使用催化剂 Pt/Ru
B.使用催化剂 Cu/TiO2
C.增大 NH3和 O2 的初始投料比
D.投料比不变,增加反应物的浓度
E.降低反应温度
(4)采用氨水吸收烟气中的 SO2,
①若氨水与 SO2恰好完全反应生成正盐,则此时溶液呈碱性(填“酸”或“碱”). 常温下弱电解质的电离平衡常数如下:氨水:Kb=1.8×10-5mol•L-1;H2SO3:Ka1=1.3×10-2mol•L-1,Ka2=6.3×10-8mol•L-1
②上述溶液中通入SO2(填“SO2”或 NH3”)气体可使溶液呈中性,此时溶液中$\frac{c{(NH}_{4}^{+})}{c(S{{O}_{3}}^{2-})}$>2(填“>”“<”或“=”)
反应 I:4NH3(g)+5O2(g)$\stackrel{PtRu}{?}$4NO(g)+6H2O(g)△H=-905.0kJ•mol-1
反应 II:4NH3(g)+3O2(g)$?_{高温}^{CU/TiO_{2}}$2N2(g)+6H2O(g)△H
(1)
| 化学键 | H-O | O=O | N≡N | N-H |
| 键能KJ•mol-1 | 463 | 496 | 942 | 391 |
(2)在恒温恒容装置中充入一定量的 NH3 和 O2,在某催化剂的作用下进行反应 I,则下 列有关叙述中正确的是A.
A.使用催化剂时,可降低该反应的活化能,加快其反应速率
B.若测得容器内 4v 正(NH3)=6v 逆(H2O)时,说明反应已达平衡
C.当容器内 $\frac{n(NO)}{n(N{H}_{3})}$=1 时,说明反应已达平衡
(3)氨催化氧化时会发生上述两个竞争反应 I、II.为分析某催化剂对该反应的选择性,在 1L 密闭容器中充入 1mol NH3和 2mol O2,测得有关物质的量关系如图:

①该催化剂在高温时选择反应I(填“I”或“II”).
②520℃时,4NH3(g)+5O2?4NO(g)+6H2O(g)的平衡常数K=$\frac{0.{2}^{4}×0.{9}^{6}}{0.{4}^{4}×1.4{5}^{5}}$(不要求得出计算结果,只需列出数字计算式).
③有利于提高 NH3 转化为 N2 平衡转化率的措施有E
A.使用催化剂 Pt/Ru
B.使用催化剂 Cu/TiO2
C.增大 NH3和 O2 的初始投料比
D.投料比不变,增加反应物的浓度
E.降低反应温度
(4)采用氨水吸收烟气中的 SO2,
①若氨水与 SO2恰好完全反应生成正盐,则此时溶液呈碱性(填“酸”或“碱”). 常温下弱电解质的电离平衡常数如下:氨水:Kb=1.8×10-5mol•L-1;H2SO3:Ka1=1.3×10-2mol•L-1,Ka2=6.3×10-8mol•L-1
②上述溶液中通入SO2(填“SO2”或 NH3”)气体可使溶液呈中性,此时溶液中$\frac{c{(NH}_{4}^{+})}{c(S{{O}_{3}}^{2-})}$>2(填“>”“<”或“=”)
19.如表所示为部分短周期元素的原子半径及主要化合价,根据表中信息判断以下叙述正确的是( )
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.071 | 0.099 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -1 |
| A. | A、B简单离子半径大小关系为B3+>A2+ | |
| B. | A、B、E对应原子的第一电离能大小为:E>A>B | |
| C. | 气态氢化物的稳定性:HD<H2C | |
| D. | 最高价氧化物对应的水化物的酸性:H2CO4>HEO4 |
20.A和B均为短周期元素,它们的离子A-和B2+具有相同的核外电子层结构.下面说法正确的是( )
| A. | 原子序数A>B | B. | 核外电子数为B>A | C. | 原子半径A>B | D. | 离子半径 B2+>A- |
 $\stackrel{铑催化剂}{→}$
$\stackrel{铑催化剂}{→}$ (R1代表氢原子或烃基)
(R1代表氢原子或烃基)
 +
+ $\stackrel{碱}{→}$
$\stackrel{碱}{→}$ +H2O
+H2O .
.