题目内容
1.已知An+、B(n+1)+、Cn-、D(n+1)-具有相同的电子层结构.下列关于A、B、C、D四种元素的叙述中正确的是( )| A. | 气态氢化物的稳定性:D>C | |
| B. | 原子序数:B>A>C>D | |
| C. | 最高价氧化物对应水化物的碱性:B>A | |
| D. | 四种元素一定都属于短周期元素 |
分析 An+、B(n+1)+、Cn-、D(n+1)-具有相同的电子层结构,则A、B为金属、C、D为非金属,且C、D位于A、B的上一个周期,同周期原子序数越大,金属性越弱、非金属性越强,以此来解答.
解答 解:A.C、D均为非金属,C的电荷数小、原子序数大,非金属性C>D,则气态氢化物的稳定性:D<C,故A错误;
B.C、D位于A、B的上一个周期,同周期的最外层电子数越大,原子序数越大,则原子序数:B>A>C>D,故B正确;
C.金属性A>B,则最高价氧化物对应水化物的碱性:B<A,故C错误;
D.若n=1,A、B可能为第四周期的K、Ca,而C、D为第三周期的Cl、S,故D错误;
故选B.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的位置、原子序数及元素周期律为解答的关键,侧重分析与应用能力的考查,注意具有相同电子排布的离子在周期表的位置,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.下列实验操作能达到实验目的是( )
| 选项 | 实验目的 | 操作方法 |
| A | 除去溴苯中的溴 | 将混合物倒入分液漏斗中,加入苯,充分振荡,静置,分液 |
| B | 制备氢氧化铁胶体 | 在氢氧化钠溶液中加入饱和FeCl3溶液,煮沸 |
| C | 除去Cl2中少量HCl | 将混合气体通过盛有饱和碳酸氢钠溶液的洗气瓶 |
| D | 验证CH3COONa溶液中存在水解平衡 | 取CH3COONa溶液于试管中并加入几滴酚酞试剂,再加入醋酸铵固体(其水溶液呈中性),观察溶液颜色变化 |
| A. | A | B. | B | C. | C | D. | D |
8.下列关于乙炔的化学用语正确的是( )
| A. | 摩尔质量:26 | B. | 球棍模型: | C. | 电子式: | D. | 结构式:CH≡CH |
16.因存在浓度差而产生电动势的电池称为浓差电池.利用如图所示装置进行实验,开始先闭合K2,断开Kl,一段时间后,再断开K2,闭合Kl,形成浓差电池,电流计指针偏转(Ag+浓度越大,氧化性越强).下列说法不正确的是( )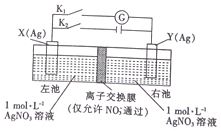

| A. | 闭合K2,断开Kl一段时间后,X电极质量增加 | |
| B. | 闭合K2,断开Kl一段时间后,右池c(AgNO3)增大 | |
| C. | 断开K2,闭合K1,X 电极发生氧化反应 | |
| D. | 断开K2,闭合K1,NO3-从左池向右池移动 |
6.下列物质中,没有顺反异构体的是( )
| A. | 2-丁烯 | B. | 1,2-二氯乙烯 | C. | 2-甲基-2-丁烯 | D. | 2-氯-2-丁烯 |
10.下列说法正确的是( )
| A. | 分子式为C6H14O的醚有15种 | |
| B. | 将气体通过酸性高锰酸钾溶液可提纯含有乙烯杂质的乙烷 | |
| C. | 分馏、干馏都属于物理变化,裂化、裂解都属于化学变化 | |
| D. | 聚乙烯、橡胶、聚酯纤维都是通过加聚反应制得的高分子化合物 |
11.用如图所示实验装置(夹持仪器己略去)探究铜丝与过量浓硫酸的反应.下列实验不合理的是( )
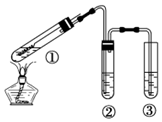

| A. | ②中选用品红溶液验证SO2的生成 | |
| B. | ③中选用NaOH溶液吸收多余的SO2 | |
| C. | 为确认有CuSO4生成,向①中加水,观察颜色 | |
| D. | 上下移动①中铜丝可控制SO2的产生与停止 |
 利用Cu+2FeCl3=CuCl2+2FeCl2反应,设计一个原电池并写出电极反应式画出示意图.
利用Cu+2FeCl3=CuCl2+2FeCl2反应,设计一个原电池并写出电极反应式画出示意图.