题目内容
5.某化学研究性学习小组用CO还原Fe2O3,并在实验结束后用磁铁吸出生成的黑色粉末X进行探究.[探究目的]分析黑色粉末X的组成,并进行相关实验.
[查阅资料]
I.CO还原Fe2O3的实验中若温度不同、受热不均时会生成Fe3O4,也能被磁铁吸引.
II.Fe3O4+8H+=2Fe3++Fe2++4H2O
[猜想假设]黑色粉末X的组成可能是Fe、Fe3O4,或二者的混合物.
[实验探究]
| 编号 | 实验操作 | 实验现象 |
| ① | 取少量黑色粉末X放入试管中,注入足量的一定浓度的盐酸,微热 | 黑色粉末逐渐溶解,同时有气泡产生,溶液呈浅绿色. |
| ② | 向上述试管中滴加几滴KSCN溶液,振荡 | 溶液没有呈现红色 |
(2)根据②中溶液未呈红色,不能推断出黑色粉末X中无Fe3O4,请用离子方程式解释原因:Fe3O4+8H+═2Fe3++Fe2++4H2O、Fe+2Fe3+═3Fe2+.
(3)为了证明黑色粉末X中是否含有Fe3O4,该小组进行如图所示实验:

请根据数据分析说明黑色粉末X中是否含有Fe3O4.方法1:因为32gFe2O3中含Fe元素为22.4g,而25.6g>22.4g,所以X中还含有O元素,还含有Fe3O4;
方法2:因为产生产生4.48L氢气,需要Fe单质为11.2g,而25.6g>11.2g,所以X中还含有Fe3O4.
分析 [猜想假设]CO还原Fe2O3为Fe生成的黑色粉末X,则根据颜色和磁性黑色粉末X可能是Fe、Fe3O4、或二者的混合物;
(1)黑色粉末X与盐酸反应有气泡产生,溶液呈浅绿色,说明铁与盐酸反应生成氢气和氯化亚铁;
(2)铁能还原铁离子为亚铁离子,不能使KSCN溶液显色;
(4)生成的红色粉末为Fe2O332.0g,据此计算其中的铁元素的质量,与25.6g样品做比较,可得,或者根据生成氢气4.48L氢气,可计算得到样品中的铁单质,与25.6g样品做比较,可得,据此分析.
解答 解:[猜想假设]CO还原Fe2O3为Fe生成的黑色粉末X,Fe、Fe3O4黑色且能被磁铁吸引,则磁性黑色粉末X可能是Fe、Fe3O4、或二者的混合物;
故答案为:Fe、Fe3O4;
(1)黑色粉末X与盐酸反应有气泡产生,溶液呈浅绿色,说明铁与盐酸反应生成氢气和氯化亚铁,离子反应为:Fe+2H+═Fe2++H2↑;
故答案为:Fe+2H+═Fe2++H2↑;
(2)黑色粉末X与盐酸反应,若铁足量,少量的Fe3O4,加盐酸溶解发生反应:Fe3O4+8H+═2Fe3++Fe2++4H2O,因为铁足量,将生成的三价铁还原为亚铁离子:Fe+2Fe3+═3Fe2+,不能使KSCN溶液显色,故根据②中溶液未呈红色,不能推断出黑色粉末X中无Fe3O4;
故答案为:Fe3O4+8H+═2Fe3++Fe2++4H2O、Fe+2Fe3+═3Fe2+;
(3)方法1:生成的红色粉末为Fe2O332.0g,因为32 g Fe2O3中含Fe元素为$\frac{112}{160}×32$g=22.4 g,而25.6 g>22.4 g,所以X中还含有O元素,还含有Fe3O4;
方法2:因为产生4.48L氢气,氢气为0.2mol,Fe单质为0.2mol×56g/mol=11.2 g,而25.6 g>11.2 g,所以X中还含有Fe3O4;
故答案为:方法1:因为32 g Fe2O3中含Fe元素为22.4 g,而25.6 g>22.4 g,所以X中还含有O元素,还含有Fe3O4;方法2:因为产生产生4.48L氢气,需要Fe单质为11.2 g,而25.6 g>11.2 g,所以X中还含有Fe3O4.
点评 本题考查了铁及其重要化合物的性质,涉及化学实验基本操作、物质的量的计算等基本原理以及定量计算测定等,对知识综合运用,考查思维能力,难度较大,清楚实验原理、思路.

| A. | 钠与水反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 纯碱溶液去油污:CO32-+H2O═HCO3-+OH- | |
| C. | Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+═SO42-+3S↓+2H2O | |
| D. | 明矾溶液中加入过量的氢氧化钡溶液:Al3++SO42-+Ba2++4OH-═BaSO4↓+AlO2-+2H2O |
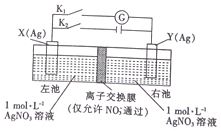
| A. | 闭合K2,断开Kl一段时间后,X电极质量增加 | |
| B. | 闭合K2,断开Kl一段时间后,右池c(AgNO3)增大 | |
| C. | 断开K2,闭合K1,X 电极发生氧化反应 | |
| D. | 断开K2,闭合K1,NO3-从左池向右池移动 |
| 实验 | ① | ② | ③ |
| 电解条件 | 阴、阳极均为石墨 | 阴、阳极均为石墨, 滴加1mL浓硫酸 | 阴极为石墨,阳极为铁,滴加1mL浓硫酸 |
| Cr2O72-的去除率/% | 0.922 | 12.7 | 57.3 |
| A. | 对比实验①②可知,降低pH可以提高Cr2O72-的去除率 | |
| B. | 实验②中,Cr2O72-在阴极放电的电极反应式是Cr2O72-+6e-+14H+═2Cr3++7H2O | |
| C. | 实验③中,Cr2O72-去除率提高的原因是Cr2O72-+6 Fe2++14H+═2Cr3++6Fe3++7H2O | |
| D. | 实验③中,理论上电路中每通过6 mol电子,则有1 mol Cr2O72-被还原 |
| A. | 分子式为C6H14O的醚有15种 | |
| B. | 将气体通过酸性高锰酸钾溶液可提纯含有乙烯杂质的乙烷 | |
| C. | 分馏、干馏都属于物理变化,裂化、裂解都属于化学变化 | |
| D. | 聚乙烯、橡胶、聚酯纤维都是通过加聚反应制得的高分子化合物 |
| A. | 氯气与氢气反应 | B. | 次氯酸分解 | C. | 甲烷与氯气反应 | D. | 氢气与氮气反应 |
| A. | 非金属单质M能从N的化合物中置换出非金属单质N | |
| B. | 在反应中M原子比N原子得到更多电子 | |
| C. | M的气态氢化物稳定性比N弱 | |
| D. | M的氧化物对应水化物的酸性比N强 |
| A. | 实验式 CH2 | B. | 结构简式 CH2=CHCH3 | ||
| C. | 球棍模型: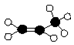 | D. | 加聚反应后的结构简式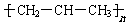 |