题目内容
2.CoO是制备电子陶瓷所需的重要原料,利用含Co3O4、Fe2O3、Al2O3的废料制备CoO的工艺流程如图: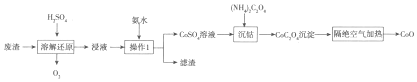
(1)Co3O4可以和热硫酸反应,则废渣中的Co3O4在溶解还原过程中发生反应的离子方程式为2Co3O4+12H+=6Co2++O2↑+6H2O,可用盐酸代替H2SO4溶液,但缺点是盐酸中Cl-有还原性,与Co3O4反应产生Cl2,污染环境.
(2)向浸液中加入氨水调节溶液的pH为6,该实验操作的目的是使Fe3+、Al3+沉淀而除去,操作1所需的玻璃仪器为玻璃棒、烧杯、漏斗.
(3)沉钴后,CoC2O4要用冷水进行洗涤,用冷水洗涤的优点是降低CoC2O4的溶解度,减少CoC2O4的损失.
(4)隔绝空气加热CoC2O4生成CoO和碳的氧化物,对应的化学方程式为CoC2O4$\frac{\underline{\;\;△\;\;}}{\;}$CoO+CO↑+CO2↑.
(5)CoC2O4在空气中加热时会生成另外一种钴的氧化物,若4.41g CoC2O4在空气中完全分解后生成的固体质量为2.41g,则该钴的氧化物的化学式为Co3O4.
分析 利用含Co3O4、Fe2O3、Al2O3的废料,向废料中加入热硫酸,发生反应2Co3O4+6H2SO4=6CoSO4+O2↑+6H2O、Fe2O3+3H2SO4=Fe2(SO4)3+3H2O、Al2O3+3H2SO4=Al2(SO4)3+3H2O,得到含有Co的溶液,向溶液中加入氨水调节溶液的pH,得到可溶性的CoSO4和Fe(OH)3和Al(OH)3沉淀,过滤得到滤渣Fe(OH)3和Al(OH)3,滤液中含有CoSO4,向滤液中再加入(NH4)2C2O4溶液,得到CoC2O4沉淀,经过滤、洗涤、干燥得到草酸钴晶体,煅烧草酸钴晶体得到CoO,结合题目分析解答;
(1)Co3O4可以和热硫酸反应生成CoSO4,用盐酸代替H2SO4溶液容易产生CI2;
(2)向浸液中加入氨水调节溶液的pH为6,该实验操作的目的是使Fe3+、Al3+沉淀;操作1是过滤;
(3)温度低,CoC2O4的溶解度减小;
(4)依据原子守恒配平书写反应的化学方程式,据此书写化学方程式;
(5)根据质量守恒计算出氧元素的物质的量,据此求解化学式.
解答 解:(1)Co3O4与硫酸根反应生成硫酸钴,反应的离子方程式为2Co3O4+12H+=6Co2++O2↑+6H2O;盐酸中Cl-有还原性,与Co3O4反应产生Cl2,污染环境,
故答案为:2Co3O4+12H+=6Co2++O2↑+6H2O;盐酸中Cl-有还原性,与Co3O4反应产生Cl2,污染环境;
(2)向浸液中加入氨水调节溶液的pH为6,该实验操作的目的是使Fe3+、Al3+沉淀而除去;操作1是过滤,所需的玻璃仪器有;玻璃棒、烧杯、漏斗,
故答案为:使Fe3+、Al3+沉淀而除去;玻璃棒、烧杯、漏斗;
(3)温度低,CoC2O4的溶解度减小,用冷水进行洗涤可减少CoC2O4的损失,
故答案为:降低CoC2O4的溶解度,减少CoC2O4的损失;
(4)依据原子守恒配平书写反应的化学方程式为CoC2O4$\frac{\underline{\;\;△\;\;}}{\;}$CoO+CO↑+CO2↑,
故答案为:CoC2O4$\frac{\underline{\;\;△\;\;}}{\;}$CoO+CO↑+CO2↑;
(5)煅烧4.41g (0.03mol)CoC2O4生成钴氧化物,测得充分煅烧后固体质量为2.41g,含钴元素的物质的量为0.03mol,质量为0.03mol×59g/mol=1.77g,氧元素的质量为2.41g-1.77g=0.64g,其物质的量为0.04mol,据此可知化学式为Co3O4,
故答案为:Co3O4.
点评 本题考查了物质分离和提纯的方法,实验过程和物质性质的判断,离子方程式、化学方程式书写方法,化学式的计算分析应用,掌握基础是解题关键,题目难度中等.

| A. | 标准状况下,22.4 L Cl2与足量水反应,转移的电子数目等于NA | |
| B. | 17 g-18OH所含的电子数目为9NA | |
| C. | 16 g N2 H4中含有的非极性共价键数目为0.5NA | |
| D. | 常温时,1 L pH=12的 Ba(OH)2溶液中含OH一的数目为2×10-2NA |
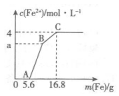 某100mL稀溶液中只含有Fe3+、Cu2+、H+、NO3-四种离子,向其中逐渐加入铁粉,溶液中Fe2+的浓度和加入铁粉的质量的关系如图所示,若整个反应过程中溶液的体积不发生变化,则下列说法中不正确的是( )
某100mL稀溶液中只含有Fe3+、Cu2+、H+、NO3-四种离子,向其中逐渐加入铁粉,溶液中Fe2+的浓度和加入铁粉的质量的关系如图所示,若整个反应过程中溶液的体积不发生变化,则下列说法中不正确的是( )| A. | 原溶液的c(H+)=4 mol•L-1 | |
| B. | 若a=3,则原溶液中c(Cu2+)=1 mol•L-1 | |
| C. | 原溶液中的c(NO3)=7 mol•L-1 | |
| D. | BC段发生反应的离子方程式为Cu2++Fe═Fe2++Cu |
| A. | CO32- | B. | AlO2- | C. | Ca2+ | D. | Ag+ |
| 选项 | 物质(括号内为杂质) | 实验方法 |
| A | K2SO4 (K2CO3) | 加入稀硫酸使溶液呈中性 |
| B | NaCl (KNO3) | 样品配制成热饱和溶液,冷却结晶,过滤 |
| C | CO2(HCl) | 通过NaHCO3饱和溶液,干燥 |
| D | 溴苯(溴) | 加入足量NaOH溶液,充分振荡,分液 |
| A. | A | B. | B | C. | C | D. | D |
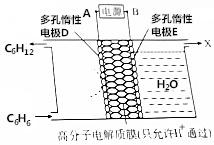 利用电化学原理,使苯(C6H6)转化为环己烷(C6H12)可实现电化学储氢和储能;反应装置如图所示,下列判断错误的是( )
利用电化学原理,使苯(C6H6)转化为环己烷(C6H12)可实现电化学储氢和储能;反应装置如图所示,下列判断错误的是( )| A. | A极为电源的正极 | |
| B. | 储氢反应的电极反应式为:C6H6+6H++6e-═C6H12 | |
| C. | 右室得到的气体X为O2 | |
| D. | 该储氢和储能的反应为2C6H6+6H2O$\frac{\underline{\;通电\;}}{\;}$2C6H12+3O2↑ |
 二氧化硫在生产和生活中有重要的应用.
二氧化硫在生产和生活中有重要的应用. S+2CO2.
S+2CO2.