题目内容
12.下列说法中不正确的是( )| A. | 常温下,0.l mol•L-1CH3COOH溶液的pH=3,则CH3COOH的电离平衡常数约为10-5 | |
| B. | 常温下,pH=7的溶液中,K+、NH4+、NO3-、CH3COO-能大量共存 | |
| C. | 将NH3通入热的CuSO4溶液中能使Cu2+还原成Cu | |
| D. | 向Fe(OH)3胶体中逐滴加入盐酸,可观察到先生成红褐色沉淀,后沉淀溶解 |
分析 A.结合Ka=$\frac{c({H}^{+})c(C{H}_{3}CO{O}^{-})}{c(C{{H}_{3}}^{\;}COOH)}$计算;
B.pH=7的溶液,该组离子之间不反应;
C.NH3通入热的CuSO4溶液,生成蓝色沉淀;
D.先发生胶体聚沉,后沉淀与盐酸反应.
解答 解:A.常温下,0.l mol•L-1CH3COOH溶液的pH=3,则CH3COOH的电离平衡常数约为Ka=$\frac{1{0}^{-3}×1{0}^{-3}}{0.1-1{0}^{-3}}$≈10-5,故A正确;
B.pH=7的溶液,该组离子之间不反应,可大量共存,故B正确;
C.NH3通入热的CuSO4溶液,生成蓝色沉淀,不发生氧化还原反应,故C错误;
D.先发生胶体聚沉,后沉淀与盐酸反应,则观察到先生成红褐色沉淀,后沉淀溶解,故D正确;
故选C.
点评 本题考查较综合,为高频考点,把握电离平衡常数计算、离子共存及物质的性质为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应的判断,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.下列除去杂质的方法正确的是( )
| A. | 除去 CO2中混有的 CO,通入 O2点燃 | |
| B. | 除去铜器表面的铜绿[Cu2 (OH)2CO3]:用盐酸浸泡,再用清水冲洗 | |
| C. | 除去 FeCl3 溶液中的 FeCl2 杂质,加入足量铁粉,再过滤即可 | |
| D. | 除去 Al2O3的 MgO 加入足量的稀盐酸,再过滤即可 |
3.下列离子方程式书写正确的是( )
| A. | 向酸性KlO3溶液中加入KI溶液:5I-+IO3-+3H2O═3I2+6OH- | |
| B. | FeS除去污水中的微量Hg2+:FeS+Hg2+═HgS+Fe2+ | |
| C. | NaHCO3溶液呈碱性:HCO3-+H2O?CO32--+H3O+ | |
| D. | AlCl3溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
20.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 能使石蕊显红色的溶液:K+、Mg2+、HCO3-、SO42- | |
| B. | 水电离出来的 c(H+)=10-13mol•L-1的溶液:NH4+、Fe2+、NO3-、Cl- | |
| C. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液:K+、Fe3+、Cl-、SO42- | |
| D. | 加入铝片能放出H2的溶液:Na+、CH3COO-、Cu2+、SO42- |
7.三氯化磷(PCl3)是一种用于有机合成的重要催化剂.实验室常用红磷与干燥的Cl2制取PCl3,装置如图所示.
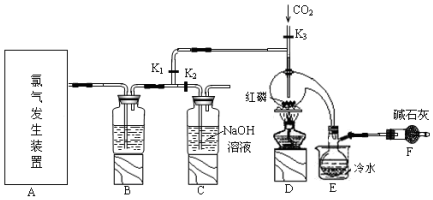
已知:红磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5.PCl3遇O2会生成POCl3(三氯氧磷),POCl3溶于PCl3,PCl3遇水会强烈水解生成H3PO3和HCl.PCl3、POCl3的熔沸点见表.
请答下面问题:
(1)玻璃管之间的连接需要用到胶皮管,连接的方法是:先把玻璃管口用水润湿;,然后稍稍用力即可把玻璃管插入橡皮管.
(2)B中所盛试剂是浓硫酸,F中碱石灰的作用是吸收多余的Cl2,防止空气中的水蒸气进入烧瓶与PCl3反应.
(3)实验时,检查装置气密性后,向D装置的曲颈瓶中加入红磷,打开K3通入干燥的CO2,一段时间后,关闭K3,加热曲颈瓶至上部有黄色升华物出现时通入氯气,反应立即进行.通干燥CO2的作用是排尽装置中的空气,防止红磷与空气中的氧气发生自燃,C装置中的K1、K2的设计也出于类似的目的,为了达到这-实验目的,实验时与K1、K2有关的操作是先关闭K1,打开K2,等B中溶液上方充满黄绿色气体后,打开K1,关闭K2.
(4)实验制得的粗产品中常含有POCl3、PCl5等.加入红磷加热除去PCl5后,通过蒸馏(填实验操作名称),即可得到较纯净的PCl3.
(5)通过下面方法可测定产品中PCl3的质量分数:
①迅速称取1.00g产品,加水反应后配成250mL溶液:
②取以上溶液25.00mL,向其中加入10.00mL0.1000mol/L碘水(足量),充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000mol/L的Na2S2O3溶液滴定;
④重复②、③操作,平均消耗0.1000mol/L Na2S2O3溶液8.00mL.
己知:H3PO3+I2+H2O=H3PO4+2HI,I2+2Na2S2O3=2NaI+Na2S4O6,根据上述数据,假设测定过程中没有其他反应,该产品中PCl3的质量分数为82.5%.

已知:红磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5.PCl3遇O2会生成POCl3(三氯氧磷),POCl3溶于PCl3,PCl3遇水会强烈水解生成H3PO3和HCl.PCl3、POCl3的熔沸点见表.
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
(1)玻璃管之间的连接需要用到胶皮管,连接的方法是:先把玻璃管口用水润湿;,然后稍稍用力即可把玻璃管插入橡皮管.
(2)B中所盛试剂是浓硫酸,F中碱石灰的作用是吸收多余的Cl2,防止空气中的水蒸气进入烧瓶与PCl3反应.
(3)实验时,检查装置气密性后,向D装置的曲颈瓶中加入红磷,打开K3通入干燥的CO2,一段时间后,关闭K3,加热曲颈瓶至上部有黄色升华物出现时通入氯气,反应立即进行.通干燥CO2的作用是排尽装置中的空气,防止红磷与空气中的氧气发生自燃,C装置中的K1、K2的设计也出于类似的目的,为了达到这-实验目的,实验时与K1、K2有关的操作是先关闭K1,打开K2,等B中溶液上方充满黄绿色气体后,打开K1,关闭K2.
(4)实验制得的粗产品中常含有POCl3、PCl5等.加入红磷加热除去PCl5后,通过蒸馏(填实验操作名称),即可得到较纯净的PCl3.
(5)通过下面方法可测定产品中PCl3的质量分数:
①迅速称取1.00g产品,加水反应后配成250mL溶液:
②取以上溶液25.00mL,向其中加入10.00mL0.1000mol/L碘水(足量),充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000mol/L的Na2S2O3溶液滴定;
④重复②、③操作,平均消耗0.1000mol/L Na2S2O3溶液8.00mL.
己知:H3PO3+I2+H2O=H3PO4+2HI,I2+2Na2S2O3=2NaI+Na2S4O6,根据上述数据,假设测定过程中没有其他反应,该产品中PCl3的质量分数为82.5%.
17.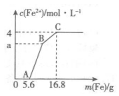 某100mL稀溶液中只含有Fe3+、Cu2+、H+、NO3-四种离子,向其中逐渐加入铁粉,溶液中Fe2+的浓度和加入铁粉的质量的关系如图所示,若整个反应过程中溶液的体积不发生变化,则下列说法中不正确的是( )
某100mL稀溶液中只含有Fe3+、Cu2+、H+、NO3-四种离子,向其中逐渐加入铁粉,溶液中Fe2+的浓度和加入铁粉的质量的关系如图所示,若整个反应过程中溶液的体积不发生变化,则下列说法中不正确的是( )
 某100mL稀溶液中只含有Fe3+、Cu2+、H+、NO3-四种离子,向其中逐渐加入铁粉,溶液中Fe2+的浓度和加入铁粉的质量的关系如图所示,若整个反应过程中溶液的体积不发生变化,则下列说法中不正确的是( )
某100mL稀溶液中只含有Fe3+、Cu2+、H+、NO3-四种离子,向其中逐渐加入铁粉,溶液中Fe2+的浓度和加入铁粉的质量的关系如图所示,若整个反应过程中溶液的体积不发生变化,则下列说法中不正确的是( )| A. | 原溶液的c(H+)=4 mol•L-1 | |
| B. | 若a=3,则原溶液中c(Cu2+)=1 mol•L-1 | |
| C. | 原溶液中的c(NO3)=7 mol•L-1 | |
| D. | BC段发生反应的离子方程式为Cu2++Fe═Fe2++Cu |
4.有关氯化钠叙述错误的是( )
| A. | 是强电解质 | B. | 固体能导电 | ||
| C. | 电子式为: | D. | 25℃时,溶液的pH=7 |
5.下列水溶液凝固点最高的是( )
| A. | 0.1mol/LKCl | B. | 0.1mol/LCH3COOH | C. | 0.1mol/LHCl | D. | 0.1mol/LK2SO4 |
6.NA代表阿伏加德罗常数值.下列叙述正确的是( )
| A. | 37g丙酸中存在的羧基数目为NA | |
| B. | 1L0.1mol•L-1H2SO3溶液中HSO3-和SO32-离子数之和为0.1NA | |
| C. | 0.5molK在空气中燃烧生成多种氧化物,充分燃烧时转移电子数为NA | |
| D. | 在标准状况下,11.2L乙烷分子所含质子数为9NA |