题目内容
7. 在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物.实验中其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去).根据图示判断下列说法不正确的是( )
在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物.实验中其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去).根据图示判断下列说法不正确的是( )| A. | 实验进行时试管 A 中应加入的试剂是普通铁粉 | |
| B. | 烧瓶 B 的作用是防止倒吸,烧瓶 C 的作用是产生水蒸气 | |
| C. | 试管 D 中收集得到的是 H2 | |
| D. | 3 mol 单质 Fe 全部转变为 Fe3O4,失去 8 mol 电子 |
分析 由图可知,A中应加入的试剂是普通铁粉,B为产生水蒸气的装置,C为安全瓶防止倒吸的作用,D中收集的是氢气,加热时发生3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$4H2+Fe3O4,以此来解答.
解答 解:A.发生固体与水蒸气的反应,则试管A中应加入的试剂是普通铁粉,故A正确;
B.B为产生水蒸气的装置,C为安全瓶防止倒吸的作用,故B错误;
C.发生3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$4H2+Fe3O4,D中排水法收集的气体为氢气,故C正确;
D.3molFe失去电子与4molH2O得到电子相同,由H元素的化合价变化可知,转移电子为4mol×2×(1-0)=8mol,故D正确;
故选B.
点评 本题考查性质实验设计,为高频考点,把握实验装置的作用、发生的反应为解答的关键,侧重分析与实验能力的考查,注意B、C的作用为解答的难点,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.称取(NH4)2SO4和NH4HSO4混合物样品7.58g,加入含0.1mol NaOH的溶液,加热充分反应,生成NH3 1792mL(标准状况),则(NH4)2SO4和NH4HSO4的物质的量比为( )
| A. | 1:2 | B. | 3:2 | C. | 2:3 | D. | 2:1 |
18.下列关于强电解质、弱电解质、非电解质的归类,完全正确的是( )
| A | B | C | D | |
| 强电解质 | C12H22O11 | BaSO4 | NaOH | H3PO4 |
| 弱电解质 | CH3COOH | HF | NH3•H2O | HClO |
| 非电解质 | S | CO2 | 盐酸 | C2H5OH |
| A. | A | B. | B | C. | C | D. | D |
15.某矿石由前20号元素中的4种组成,其化学式为WYZX4.X、Y、Z、W分布在三个周期,原子序数依次增大,W、Y为金属元素,X原子的最外层电子数是次外层电子数的3倍,W能与冷水剧烈反应,Y、Z原子的最外层电子数之和与X、W原子的最外层电子数之和相等,Y、Z位于同周期,Z单质是一种良好的半导体.下列说法正确的是( )
| A. | 原子半径:W>Y>Z>X | |
| B. | 气态氢化物的稳定性:X<Z | |
| C. | 最高价氧化物对应水化物的碱性:Y>W | |
| D. | Y的氧化物是酸性氧化物 |
2.下列除去杂质的方法正确的是( )
| A. | 除去 CO2中混有的 CO,通入 O2点燃 | |
| B. | 除去铜器表面的铜绿[Cu2 (OH)2CO3]:用盐酸浸泡,再用清水冲洗 | |
| C. | 除去 FeCl3 溶液中的 FeCl2 杂质,加入足量铁粉,再过滤即可 | |
| D. | 除去 Al2O3的 MgO 加入足量的稀盐酸,再过滤即可 |
19.下列实验操作能达到实验目的是( )
| A. | 用排饱和氯化铵溶液的方法收集氨气 | |
| B. | 用重结晶的方法除去BaSO4固体中混有的NaCl | |
| C. | 将碳酸钙置于蒸发皿中高温灼烧可得到氧化钙 | |
| D. | 将硫酸铜溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到胆矾晶体 |
17.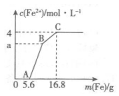 某100mL稀溶液中只含有Fe3+、Cu2+、H+、NO3-四种离子,向其中逐渐加入铁粉,溶液中Fe2+的浓度和加入铁粉的质量的关系如图所示,若整个反应过程中溶液的体积不发生变化,则下列说法中不正确的是( )
某100mL稀溶液中只含有Fe3+、Cu2+、H+、NO3-四种离子,向其中逐渐加入铁粉,溶液中Fe2+的浓度和加入铁粉的质量的关系如图所示,若整个反应过程中溶液的体积不发生变化,则下列说法中不正确的是( )
 某100mL稀溶液中只含有Fe3+、Cu2+、H+、NO3-四种离子,向其中逐渐加入铁粉,溶液中Fe2+的浓度和加入铁粉的质量的关系如图所示,若整个反应过程中溶液的体积不发生变化,则下列说法中不正确的是( )
某100mL稀溶液中只含有Fe3+、Cu2+、H+、NO3-四种离子,向其中逐渐加入铁粉,溶液中Fe2+的浓度和加入铁粉的质量的关系如图所示,若整个反应过程中溶液的体积不发生变化,则下列说法中不正确的是( )| A. | 原溶液的c(H+)=4 mol•L-1 | |
| B. | 若a=3,则原溶液中c(Cu2+)=1 mol•L-1 | |
| C. | 原溶液中的c(NO3)=7 mol•L-1 | |
| D. | BC段发生反应的离子方程式为Cu2++Fe═Fe2++Cu |