题目内容
7.如图所示是分离混合物时常用的仪器,回答下列问题: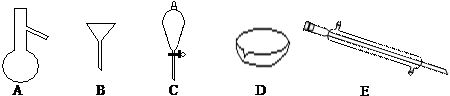
(1)写出上述仪器的名称A蒸馏烧瓶 C分液漏斗 E冷凝管
(2)分离以下混合物应该主要选用上述什么仪器?(填字母符号)
①粗盐和泥沙:B ②花生油和水:C
(3)关于仪器的使用,下列说法不正确的是AE
A.A仪器可以用酒精灯直接加热
B.B仪器可以用于过滤
C.C仪器在放出液体时应打开上边的塞子
D.在实验室应用D仪器进行实验时要不断用玻璃棒搅拌
E.蒸馏时,E仪器中水的流向是上口进,下口出
(4)若向C装置中加入碘水和足量CCl4,充分振荡后静置,会观察到什么现象?分液漏斗内液体分两层,上层液体几乎呈无色,下层液体呈紫红色.
分析 (1)由图可知仪器的名称;
(2)①泥沙不溶于水,粗盐溶于水;
②花生油和水分层;
(3)A.蒸馏烧瓶需要垫上石棉网加热;
B.普通漏斗用于分离不溶性固体与液体;
C.分液漏斗分离液体,需要打开塞子和活塞;
D.蒸发皿蒸发时利用玻璃棒不断搅拌,防止局部温度过高;
E.冷凝管中水下进上出,冷凝效果好;
(4)C装置中加入碘水和足量CCl4,碘易溶于四氯化碳在下层.
解答 解:(1)由图可知,A、C、E分别为蒸馏烧瓶、分液漏斗、冷凝管,故答案为:蒸馏烧瓶;分液漏斗;冷凝管;
(2)①泥沙不溶于水,粗盐溶于水,则选择B进行过滤分离,故答案为:B;
②花生油和水分层,则选择C进行分液分离,故答案为:C;
(3)A.蒸馏烧瓶需要垫上石棉网加热,不能直接加热,故A错误;
B.普通漏斗用于分离不溶性固体与液体,则B仪器可以用于过滤,故B正确;
C.分液漏斗分离液体,需要打开塞子和活塞,操作合理,故C正确;
D.蒸发皿蒸发时利用玻璃棒不断搅拌,防止局部温度过高,液滴飞溅,操作合理,故D正确;
E.冷凝管中水下进上出,冷凝效果好,操作不合理,故E错误;
故答案为:AE;
(4)C装置中加入碘水和足量CCl4,碘易溶于四氯化碳在下层,观察到的现象为分液漏斗内液体分两层,上层液体几乎呈无色,下层液体呈紫红色,
故答案为:分液漏斗内液体分两层,上层液体几乎呈无色,下层液体呈紫红色.
点评 本题考查物质的分离、提纯,为高频考点,侧重于学生的分析、实验能力的考查,注意把握仪器的使用及混合物分离方法等为解答的关键,题目难度不大.

练习册系列答案
相关题目
17.已知NH4CuSO3与足量的5mol•L-1硫酸溶液混合微热,产生下列现象::①有红色金属生成 ②产生刺激性气味的气体 ③溶液呈现蓝色.据此判断下列说法正确的是( )
| A. | 反应中硫酸作氧化剂 | |
| B. | NH4CuSO3中硫元素被氧化 | |
| C. | 刺激性气味的气体是氨气 | |
| D. | 1mol NH4CuSO3完全反应转移0.5mol电子 |
18.下列离子方程式正确的是( )
| A. | 向含有Fe203的悬浊液中通入HI:Fe203+6H+═2Fe3++3H20 | |
| B. | 1mol/L NaAl02 溶液和 1.5 mol/L HCl 溶液等体积混合:6Al02+9H++3H20═5Al(0H)3↓+Al3+ | |
| C. | 向Ca(Cl0)2溶液中通入足量S02:Ca2++2Cl0-+S02+H20═CaS03↓+2HCl0 | |
| D. | 向 0.1mol/L、pH=1的NaHA 溶液中加入NaOH溶液:HA-+0H-═H20+A2- |
15.下列装置所示的实验中,能达到实验目的是( )
| A. |  分离碘酒中 的碘和酒精 | B. | 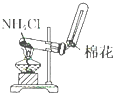 实验室制氧气 | ||
| C. | 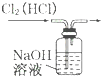 除去Cl2中的HCl | D. | 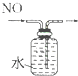 排水集气法收集NO |
2. 工业合成氨反应为:N2(g)+3H2(g)?2NH3(g),对其研究如下:
工业合成氨反应为:N2(g)+3H2(g)?2NH3(g),对其研究如下:
(1)已知H-H键能为436kJ•mol-1,N-H键能为391kJ•mol-1,N≡N键的键能是945.6kJ•mol-1,则上述反应的△H=-92.46kJ•mol-1.
(2)在773K时,分别将2molN2和6molH2充入一个固定容积为1L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表:
①该温度下,若向同容积的另一容器中投入的N2、H2、NH3浓度分别为3mol/L,3mol/L、3mol/L,此时v正大于v逆(填“大于”、“小于”或“等于”)
②由上述表中的实验数据计算得到“浓度~时间”的关系可用图中的曲线表示,表示c(N2)~t的曲线是乙.在此温度下,若起始充入4molN2和12molH2,反应刚达到平衡时,表示c(H2)的曲线上相应的点为B.
 工业合成氨反应为:N2(g)+3H2(g)?2NH3(g),对其研究如下:
工业合成氨反应为:N2(g)+3H2(g)?2NH3(g),对其研究如下:(1)已知H-H键能为436kJ•mol-1,N-H键能为391kJ•mol-1,N≡N键的键能是945.6kJ•mol-1,则上述反应的△H=-92.46kJ•mol-1.
(2)在773K时,分别将2molN2和6molH2充入一个固定容积为1L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表:
| t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
| n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
②由上述表中的实验数据计算得到“浓度~时间”的关系可用图中的曲线表示,表示c(N2)~t的曲线是乙.在此温度下,若起始充入4molN2和12molH2,反应刚达到平衡时,表示c(H2)的曲线上相应的点为B.
19.下列有关物质浓度关系的描述中,正确的是( )
| A. | 25℃时,NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7mol•L-1 | |
| B. | 25℃时,向0.1mol•L-1NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+) | |
| C. | 0.1mol•L-1的NaHCO3溶液中:c(OH-)+2c(CO32-)=c(H+)+c(H2CO3) | |
| D. | 同温下,pH相同时,溶液物质的量浓度:c(CH3COONa)>c(NaHCO3)>c(Na2CO3)>c(C6H5ONa) |
17.下列叙述正确的是( )
| A. | 分子式为C3H6有机物最多存在3个C-C单键,与C4H10的碳碳单键数相同 | |
| B. | 乙烯、聚氯乙烯和苯分子中均含有碳碳双健 | |
| C. | 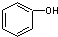 和 C7H8O分子组成相差一个-CH2-,因此是同系物关系 和 C7H8O分子组成相差一个-CH2-,因此是同系物关系 | |
| D. | 分子式为C2H6O的红外光谱图上发现有C-H键和C-O键的振动吸收,由此可以确定有机物结构简式为C2H5-OH |
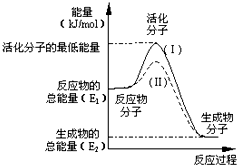 在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变为活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察图,然后回答问题:
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变为活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察图,然后回答问题: