题目内容
16.聚合硫酸铁铝(PFAS)是一种新型高效水处理剂.利用硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等)为铁源,粉煤灰(主要成分为Al2O3、Fe2O3、FeO等)为铝源,制备PFAS的工艺流程如下:
(1)“碱溶”时,粉煤灰发生反应的化学方程式为Al2O3+2NaOH=2NaAlO2+H2O
(2)“酸溶Ⅱ”时,Fe3O4发生反应的离子方程式为Fe3O4+8H+=2Fe3++Fe2++4H2O
(3)“滤渣Ⅰ”、“滤渣Ⅱ”在本流程中能加以利用的是滤渣Ⅰ
(4)“氧化”时应控制温度不超过57℃,其原因是温度过高,H2O2会分解
(5)“氧化”时若用MnO2代替H2O2,发生反应的离子方程式是2Fe2++MnO2+4H+═2Fe3++Mn2++2H2O.
分析 粉煤灰(主要成分为Al2O3、Fe2O3、FeO等),加入NaOH溶液使Al2O3溶解,其方程式为Al2O3+2NaOH=2NaAlO2+H2O,氧化铁、氧化亚铁和氢氧化钠不反应,通入过量CO2,发生的反应为CO2+NaAlO2+2H2O=Al(OH)3↓+NaHCO3;再加入H2SO4时,其反应原理为2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O,结晶得到Al2(SO4)3晶体;硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等),向硫铁矿烧渣中加入H2SO4,其方程式为FeO+H2SO4=FeSO4+H2O,Fe3O4+8H+=2Fe3++Fe2++4H2O,二氧化硅与硫酸不反应,加入过氧化氢氧化亚铁盐为铁盐,结晶Ⅰ结晶Ⅱ制备PFAS,
(1)加入NaOH溶液使Al2O3溶解生成偏铝酸钠和水;
(2)四氧化三铁和酸反应生成铁盐、亚铁盐、水;
(3)“滤渣Ⅰ”中含有Fe2O3、FeO,“滤渣Ⅱ”中含有SiO2,根据工艺流程,滤渣Ⅰ可加以利用;
(4)H2O2氧化Fe2+时,温度不能过高,其原因是温度过高,H2O2会分解;
(5)“氧化”时若MnO2用代替H2O2,发生反应是酸溶液中二氧化锰氧化亚铁离子为铁离子,二氧化锰被还原为锰离子;
解答 解:粉煤灰(主要成分为Al2O3、Fe2O3、FeO等),加入NaOH溶液使Al2O3溶解,其方程式为Al2O3+2NaOH=2NaAlO2+H2O,氧化铁、氧化亚铁和氢氧化钠不反应,通入过量CO2,发生的反应为CO2+NaAlO2+2H2O=Al(OH)3↓+NaHCO3;再加入H2SO4时,其反应原理为2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O,结晶得到Al2(SO4)3晶体;硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等),向硫铁矿烧渣中加入H2SO4,其方程式为FeO+H2SO4=FeSO4+H2O,Fe3O4+8H+=2Fe3++Fe2++4H2O,二氧化硅与硫酸不反应,加入过氧化氢氧化亚铁盐2Fe2++H2O2+2H+=2Fe3++2H2O为铁盐,结晶Ⅰ结晶Ⅱ制备PFAS;
(1)氧化铝为两性氧化物,“碱溶”时,Al2O3发生反应的化学方程式为Al2O3+2NaOH=2NaAlO2+H2O,
故答案为:Al2O3+2NaOH=2NaAlO2+H2O;
(2)四氧化三铁中铁$\frac{1}{3}$为+2,$\frac{2}{3}$为+3,“酸溶Ⅱ”时,Fe3O4发生反应的离子方程式为Fe3O4+8H+=2Fe3++Fe2++4H2O,
故答案为:Fe3O4+8H+=2Fe3++Fe2++4H2O;
(3)依据上述分析可知,“滤渣Ⅰ”中含有Fe2O3、FeO,“滤渣Ⅱ”中含有SiO2,根据工艺流程,滤渣Ⅰ可加以利用,
故答案为:滤渣Ⅰ;
(4)过氧化氢氧化亚铁盐为铁盐,2Fe2++H2O2+2H+=2Fe3++2H2O,H2O2氧化Fe2+时,“氧化”时应控制温度不超过57℃,其原因是温度不能过高,其原因是温度过高,H2O2会分解,
故答案为:温度过高,H2O2会分解;
(5)“氧化”时若用MnO2代替H2O2,发生反应是酸溶液中二氧化锰氧化亚铁离子为铁离子,二氧化锰被还原为锰离子,反应的离子方程式为:2Fe2++MnO2+4H+═2Fe3++Mn2++2H2O;
故答案为:2Fe2++MnO2+4H+═2Fe3++Mn2++2H2O.
点评 本题考查了物质制备实验工厂分析判断,物质性质的理解应用,离子方程式、化学方程式书写方法,盐类水解分析应用,掌握基础是关键,题目难度中等.

 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案| A. | 氧化还原反应的实质是相互交换成分 | |
| B. | 在氧化还原反应中,化合价变化的一定是不同元素 | |
| C. | 在氧化还原反应中,氧化剂与还原剂一定是不同物质 | |
| D. | 某元素由游离态转化为化合态,这种元素不一定被氧化了 |
| A. | 同质量、不同密度的N2和CO | B. | 同温度、同体积的H2和N2 | ||
| C. | 同体积、同密度的C2H6和NO | D. | 同压强、同体积的N2O和CO2 |
| A. | 质量数为14的碳原子的表达式:${\;}_{8}^{14}$C | |
| B. | 乙醇的结构简式:C2H5OH | |
| C. | 乙烯的结构简式为CH2CH2 | |
| D. | 甲烷分子的球棍模型: |
| A. |  点燃酒精灯 | B. |  蒸馏 | ||
| C. |  过滤 | D. |  观察K+的焰色 |
| A. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2y-x)kJ•mol-1 | |
| B. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(4x-y)kJ•mol-1 | |
| C. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2x-y)kJ•mol-1 | |
| D. | 2CO2(g)+2NaOH(l)═2NaHCO3(l)△H=-(8x-2y)kJ•mol-1 |
 已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀,且在潮湿空气中迅速变为灰绿色,最终变为红褐色固体.
已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀,且在潮湿空气中迅速变为灰绿色,最终变为红褐色固体.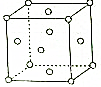 X、Y、Z、W、R是元素周期表前四周期元素中的五种常见元素,其原子序数依次增大.X的基态原子的最外层电子排布式为nsnnpn+1.Y、Z同主族且ZY2是导致酸雨的主要物质之一.R位于ds区且原子最外层只有一个电子.W原子次外层电子数为最外层电子数的7倍.请回答下列问题:
X、Y、Z、W、R是元素周期表前四周期元素中的五种常见元素,其原子序数依次增大.X的基态原子的最外层电子排布式为nsnnpn+1.Y、Z同主族且ZY2是导致酸雨的主要物质之一.R位于ds区且原子最外层只有一个电子.W原子次外层电子数为最外层电子数的7倍.请回答下列问题: