题目内容
10. 实验室用少量的溴水和足量的乙醇制备1,2-二溴乙烷的装置如图所示,有关数据列表如下:
实验室用少量的溴水和足量的乙醇制备1,2-二溴乙烷的装置如图所示,有关数据列表如下:| 乙醇 | 1,2-二溴乙烷 | 醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -l30 | 9 | -1l6 |
(1)烧瓶A中发生的主要的反应方程式CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O.
(2)装置B的作用是平衡压强,作安全瓶,防止倒吸.
(3)在装置C中应加入c(填字母).
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)若产物中有少量未反应的Br2,最好用e(填字母)洗涤除去.
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇 e.Na2SO3溶液
(5)若产物中有少量副产物乙醚,可用蒸馏的方法除去.
(6)反应过程中应用冷水冷却装置D,但又不能过度冷却(如用冰水),其原因是产品熔点低,过度冷却会凝固而堵塞导管口.
(7)判断该制备反应已经结束的最简单方法是D中溴水完全褪色.
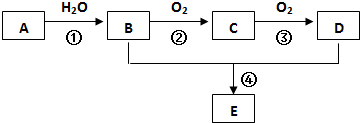
分析 用少量的溴水和足量的乙醇制备1,2-二溴乙烷,结合实验装置可知,A装置是实验室制取乙烯,B是安全瓶,C是排除干扰装置,D是制取1,2-二溴乙烷装置,
(1)乙醇与浓硫酸加热至170℃发生消去反应生成乙烯;
(2)装置B是安全瓶;
(3)C中NaOH溶液可吸收二氧化硫、二氧化碳等酸性氧化物;
(4)溴与碱反应后,与1,2-二溴乙烷分层,但不能利用能使卤代烃水解的NaOH溶液;
(5)利用互溶液体的沸点差异分离;
(6)温度过低,凝固后堵塞导管;
(7)溴水有颜色,而1,2-二溴乙烷为无色,以此来解答.
解答 解:A装置是实验室制取乙烯,B是安全瓶,C是排除干扰装置,D是制取1,2-二溴乙烷装置.
(1)根据上述分析,烧瓶A中发生的主要的反应方程式是CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O,
故答案为:CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O;
(2)根据上述分析,装置B是安全瓶,所以装置B的作用是平衡压强,作安全瓶,防止倒吸,
故答案为:平衡压强,作安全瓶,防止倒吸;
(3)C是排除干扰装置,浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫,二氧化碳、二氧化硫能和氢氧化钠溶液反应,因此,C中加入的是氢氧化钠溶液,其作用是除去可能产生的酸性气体SO2、CO2,
故答案为:c;
(4)因1,2-二溴乙烷在碱性条件下能发生取代反应,所以除去少量的Br2不用NaOH溶液,而是用与Br2反应的Na2SO3溶液,故答案为:e;
(5)乙醚与其它有机物溶且沸点相关比较大,采用分馏的方法分离,故答案为:蒸馏;
(6)溴在常温下,易挥发,乙烯与溴反应时放热,溴更易挥发,冷却可避免溴的大量挥发,但1,2-二溴乙烷的凝固点9℃较低,过度冷却会凝固而堵塞导管口,所以不能过度冷却,
故答案为:产品熔点低,过度冷却会凝固而堵塞导管口;.
(7)乙烯和溴水发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷为无色,所以判断反应结束的方法是观察D中溴水完全褪色,
故答案为:D中溴水完全褪色.
点评 本题考查有机物的制备实验,为高频考点,把握物质的性质、制备原理、实验装置的作用及实验技能为解答的关键,侧重分析与实验能力的考查,注意有机物的性质及混合物分离方法,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | H2O(g)═H2(g)+$\frac{1}{2}$O2;△H(298K)=-242kJmol-1 | |
| B. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l);△H(298K)=+484kJmol-1 | |
| C. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g);△H(298K)=-242kJmol-1 | |
| D. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g);△H(298K)=-484kJ |
| A. | Cl-和OH-向阳极定向运动,Cl-被电解,而OH-留在阳极,因此阳极区显碱性 | |
| B. | 阴极的电极反应是:4OH--4e-═O2↑+2H2O | |
| C. | 电解槽内总反应方程式为:2Cl-+2H2O═Cl2↑+H2↑+2OH- | |
| D. | 向阴阳极分别滴入2滴酚酞,现象是阴极区变成红色,阳极区不变色 |
| A. | 工业上用氮气和氢气合成氨气 | B. | 一氧化氮与氧气反应生成二氧化氮 | ||
| C. | 氨气经催化氧化生成一氧化氮 | D. | 由氨气制碳酸氢氨和硫酸氨 |
 可简写为
可简写为 降冰片烯的分子结构可表示为:
降冰片烯的分子结构可表示为:
 ;
;