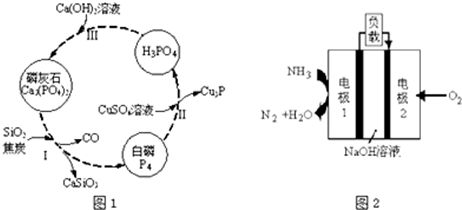
题目内容
1.用惰性电极电解饱和食盐水的说法正确的是( )| A. | Cl-和OH-向阳极定向运动,Cl-被电解,而OH-留在阳极,因此阳极区显碱性 | |
| B. | 阴极的电极反应是:4OH--4e-═O2↑+2H2O | |
| C. | 电解槽内总反应方程式为:2Cl-+2H2O═Cl2↑+H2↑+2OH- | |
| D. | 向阴阳极分别滴入2滴酚酞,现象是阴极区变成红色,阳极区不变色 |
分析 用惰性电极电解饱和食盐水时,阴极上氢离子得电子发生还原反应,生成氢气;阳极上氯离子失去电子发生氧化反应,生气氯气,阴离子向阳极区移动,阳离子向阴极区移动,据此分析解答.
解答 解:A、阴离子向阳极区移动,即Cl-和OH-向阳极定向运动,阳极区氯离子失去电子生成氯气,阴极区不显碱性,氢氧化钠在阴极区生成,阴极区显碱性,故A错误;
B、阴极的电极反应是:2H++2e-=H2↑,故B错误;
C、总反应应该写明反应的条件,为电解或通电,故C错误;
D、电解饱和食盐水时,阴极上时氢离子发生得电子的还原反应,生成氢气,氢离子浓度减小,氢氧根离子浓度增大,钠离子移向该电极,该电极会产生大量的氢氧化钠,阳极区氯离子失去电子生成氯气,向阴阳极分别滴入2滴酚酞,现象是阴极区变成红色,阳极区不变色,故D正确;
故选D.
点评 本题考查电解原理,明确电解池阴阳极的判断方法、阴阳极上发生反应类型及电极方程式即可解答,难度不大.

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
9.一定条件下,浓度都是1mol•L-1的两种气体X2和Y2,在密闭容器中反应,生成气体Z,4s后,X2、Y2、Z的浓度分别是0.4mol•L-1、0.8mol•L-1、0.4mol•L-1,若用X、Y表示Z的化学式,该反应的化学方程式为( )
| A. | 3X2+Y2═2X3Y | B. | 2X2+Y2═2X2Y | C. | X2+2Y2═2XY2 | D. | X2+3Y2═2XY3 |
6.在使紫色石蕊试剂变红的溶液中,能大量共存的离子是( )
| A. | Mg2+、Fe2+、SO42-、Cl- | B. | Al3+、Fe3+、I-、SO42- | ||
| C. | K+、Na+、Cl-、HCO3- | D. | Na+、Ba2+、NO3-、SO42- |
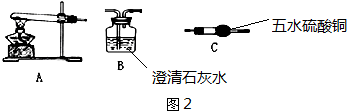
10. 实验室用少量的溴水和足量的乙醇制备1,2-二溴乙烷的装置如图所示,有关数据列表如下:
实验室用少量的溴水和足量的乙醇制备1,2-二溴乙烷的装置如图所示,有关数据列表如下:
回答下列问题:
(1)烧瓶A中发生的主要的反应方程式CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O.
(2)装置B的作用是平衡压强,作安全瓶,防止倒吸.
(3)在装置C中应加入c(填字母).
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)若产物中有少量未反应的Br2,最好用e(填字母)洗涤除去.
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇 e.Na2SO3溶液
(5)若产物中有少量副产物乙醚,可用蒸馏的方法除去.
(6)反应过程中应用冷水冷却装置D,但又不能过度冷却(如用冰水),其原因是产品熔点低,过度冷却会凝固而堵塞导管口.
(7)判断该制备反应已经结束的最简单方法是D中溴水完全褪色.
 实验室用少量的溴水和足量的乙醇制备1,2-二溴乙烷的装置如图所示,有关数据列表如下:
实验室用少量的溴水和足量的乙醇制备1,2-二溴乙烷的装置如图所示,有关数据列表如下:| 乙醇 | 1,2-二溴乙烷 | 醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -l30 | 9 | -1l6 |
(1)烧瓶A中发生的主要的反应方程式CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O.
(2)装置B的作用是平衡压强,作安全瓶,防止倒吸.
(3)在装置C中应加入c(填字母).
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)若产物中有少量未反应的Br2,最好用e(填字母)洗涤除去.
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇 e.Na2SO3溶液
(5)若产物中有少量副产物乙醚,可用蒸馏的方法除去.
(6)反应过程中应用冷水冷却装置D,但又不能过度冷却(如用冰水),其原因是产品熔点低,过度冷却会凝固而堵塞导管口.
(7)判断该制备反应已经结束的最简单方法是D中溴水完全褪色.
11.水溶液中能大量共存的一组离子是( )
| A. | Na+、Ba2+、OH-、[Al(OH)4]- | B. | Fe2+、H+、NO3-、ClO- | ||
| C. | Al3+、NH4+、Cl-、HCO3- | D. | K+、Fe3+、SO42-、SCN- |


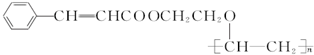 .按如图所示关系可以合成甲,其中试剂I可由乙醇与氧气在催化剂加热条件下反应得到.
.按如图所示关系可以合成甲,其中试剂I可由乙醇与氧气在催化剂加热条件下反应得到.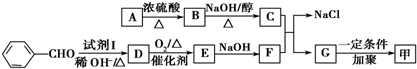
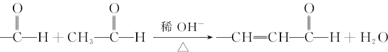
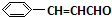 +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2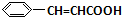 +H2O;
+H2O;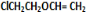 +
+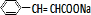 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$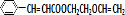 +NaCl.
+NaCl.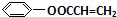 .
.