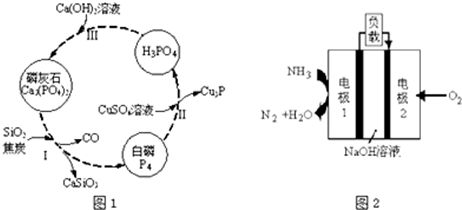
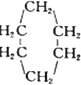
题目内容
18.高锰酸钾可用于除去地下水的硫化氢异味的原理是高锰酸钾将硫化氢氧化生成的硫,可过滤除去.水体呈弱酸性时,高锰酸钾的还原产物是MnO和MnO2,且MnO和MnO2的物质的量比为3:1.(1)实验室制取氯气的化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
(2)在处理饮用水时,活性炭应在高锰酸钾反应结束后投加,否则会发生反应:4KMnO4+3C+H2O═4MnO2+2X+K2CO3X的化学式为KHCO3.1mol氧化剂被还原(填“氧化”或“还原”)时,生成0.75mol氧化产物
(3)常温下,氢氧化锰的KSP=2.0×10-13,往含Mn2+的溶液中加入氢氧化钠溶液,调节溶液的PH=8.0,有氢氧化锰沉淀产生,则此时Mn2+的物质的量浓度最小为0.2 mol/L.
分析 (1)实验室用二氧化锰与浓盐酸反应制备氯气;
(2)根据氧化还原法配平KMn04、C的系数,再根据元素守恒确定X的化学式;反应中KMn04是氧化剂发生还原反应,被还原;根据电子转移守恒计算生成的氧化物的物质的量;
(3)溶液的PH=8.0,则c(OH-)=10-6mol/L,根据Ksp=c(Mn2+)×c2(OH-)计算.
解答 解:(1)实验室用二氧化锰与浓盐酸反应制备氯气,其反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)反应中KMnO4→Mn02,Mn元素化合价由+7价降低为+4价,共降低变化3价,C→K2CO3,C元素化合价由0价升高为+4价,共升高4价,化合价升降最小公倍数为12,故KMnO4系数为4,C的系数为3,由C、K的原子数目关系可知K2CO3系数为1,故X含有+4价的C原子、且C原子与K原子之比为1:1,故X为KHCO3;
反应中KMn04是氧化剂发生还原反应,被还原,1molKMn04被还原,氧化产物为KHCO3、K2CO3,每摩尔KHCO3、K2CO3都含1molC原子,令生成的氧化产物为amol,则根据电子转移守恒有1mol×(7-4)=amol×(4-0),解得a=0.75;
故答案为:KHCO3;还原;0.75;
(3)溶液的PH=8.0,则c(OH-)=10-6mol/L,已知Ksp=c(Mn2+)×c2(OH-),则c(Mn2+)=$\frac{2×1{0}^{-13}}{(1{0}^{-6})^{2}}$=0.2 mol/L;
故答案为:0.2 mol/L.
点评 本题考查了氧化还原反应计算、配平、基本概念和溶度积常数的有关计算,题目难度中等,(2)中X的判断为易错点、难点,实质是考查氧化还原反应的配平,侧重于考查学生对基础知识的应用能力和计算能力.

| A. | Cu2S是还原产物,反应中1 mol CuSO4失1 mol电子 | |
| B. | 5 mol FeS2发生反应,有10 mol电子转移 | |
| C. | 产物中的SO42-离子有一部分是氧化产物 | |
| D. | FeS2只作还原剂 |
| A. | 3X2+Y2═2X3Y | B. | 2X2+Y2═2X2Y | C. | X2+2Y2═2XY2 | D. | X2+3Y2═2XY3 |
| A. | Mg2+、Fe2+、SO42-、Cl- | B. | Al3+、Fe3+、I-、SO42- | ||
| C. | K+、Na+、Cl-、HCO3- | D. | Na+、Ba2+、NO3-、SO42- |
 实验室用少量的溴水和足量的乙醇制备1,2-二溴乙烷的装置如图所示,有关数据列表如下:
实验室用少量的溴水和足量的乙醇制备1,2-二溴乙烷的装置如图所示,有关数据列表如下:| 乙醇 | 1,2-二溴乙烷 | 醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -l30 | 9 | -1l6 |
(1)烧瓶A中发生的主要的反应方程式CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O.
(2)装置B的作用是平衡压强,作安全瓶,防止倒吸.
(3)在装置C中应加入c(填字母).
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)若产物中有少量未反应的Br2,最好用e(填字母)洗涤除去.
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇 e.Na2SO3溶液
(5)若产物中有少量副产物乙醚,可用蒸馏的方法除去.
(6)反应过程中应用冷水冷却装置D,但又不能过度冷却(如用冰水),其原因是产品熔点低,过度冷却会凝固而堵塞导管口.
(7)判断该制备反应已经结束的最简单方法是D中溴水完全褪色.
(1)取适量溶液,加入过量盐酸,有气体生成,并得到无色溶液;
(2)在(1)所得溶液中加入过量NH4HCO3溶液,有气体生成,同时析出白色沉淀甲;
(3)在(2)所得溶液中加入过量Ba(OH)2溶液也有气体生成,同时析出白色沉淀乙.
则下列离子在原溶液中一定存在的有( )
| A. | SO42-、AlO2-、Na+ | B. | Na+、CO32-、AlO2- | C. | CO32-、Na+、Al3+ | D. | MnO4-、Na+、CO32- |
| A. | NO2 | B. | Cl2 | C. | N2 | D. | SO2 |
 可表示为
可表示为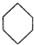 ,下面是某高聚物的合成路线,试完成下列试题:
,下面是某高聚物的合成路线,试完成下列试题: $→_{Ⅰ}^{NH}$
$→_{Ⅰ}^{NH}$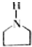 $→_{Ⅱ}^{CH=CH}$A$\stackrel{Ⅲ}{→}$
$→_{Ⅱ}^{CH=CH}$A$\stackrel{Ⅲ}{→}$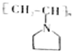
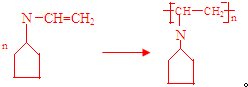 .
.