题目内容
19.下列各项中表达正确的是( )| A. | Na的原子结构示意图: | B. | NaCl的电子式:Na:Cl | ||
| C. | 乙烯的结构式:CH2=CH2 | D. | 乙醇的结构简式:CH3CH2OH |
分析 A、钠原子的最外层有1个电子;
B、氯化钠为离子化合物,由钠离子和氯离子构成;
C、根据乙烯的电子式写出乙烯的结构式;
D、乙醇由一个-OH取代了乙烷中的一个H而得到.
解答 解:A、钠原子的最外层有1个电子,故原子结构示意图为 ,故A错误;
,故A错误;
B、氯化钠是由钠离子和氯离子构成的,其电子式为: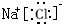 ,故B错误;
,故B错误;
C、乙烯的电子式为 ,故乙烯的结构式为
,故乙烯的结构式为 ,故C错误;
,故C错误;
D、乙醇由一个-OH取代了乙烷中的一个H而得到,故乙醇的结构简式为:CH3CH2OH,故D正确.
故选D.
点评 本题考查了常见的化学用语,难度不大,应注意的是结构式和结构简式的区别,注意基础的掌握.

练习册系列答案
相关题目
9.某合作学习小组讨论辨析以下说法正确的是( )
①粗盐和酸雨都是混合物
②硅是光导纤维的主要成分
③冰和干冰既是纯净物又是化合物
④不锈钢和目前流通的硬币都是合金
⑤盐酸和食醋既是化合物又是酸
⑥纯碱和熟石灰都是碱
⑦豆浆、雾、烟都是胶体
⑧利用丁达尔效应可以区分溶液和胶体.
①粗盐和酸雨都是混合物
②硅是光导纤维的主要成分
③冰和干冰既是纯净物又是化合物
④不锈钢和目前流通的硬币都是合金
⑤盐酸和食醋既是化合物又是酸
⑥纯碱和熟石灰都是碱
⑦豆浆、雾、烟都是胶体
⑧利用丁达尔效应可以区分溶液和胶体.
| A. | ③④⑤⑥⑦ | B. | ①②③④⑥ | C. | ①③④⑦⑧ | D. | ①②④⑤⑧ |
10.下列各项表述中正确的是( )
| A. | I-131的原子组成:5378I | B. | HCl电子式: | ||
| C. | Na2S的电子式: | D. | D2O的摩尔质量为:18g/mol |
7.某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”.
(1)已知:KMnO4+H2C2O4+H2SO4→MnSO4+K2SO4+CO2↑+H20(未配平),向酸性KMnO4溶液中加入一定量的H2C2O4溶液,当溶液中的KMnO4耗尽后,紫色溶液将褪去.为确保能观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4):n(KMnO4)≥2.5.
(2)为探究反应物浓度对化学反应速率的影响,该小组设计了如下实验方案
表中x=2.0ml,理由是保证其它条件不变,只改变反应物H2C2O4浓度,从而达到对照实验的目的.
(1)已知:KMnO4+H2C2O4+H2SO4→MnSO4+K2SO4+CO2↑+H20(未配平),向酸性KMnO4溶液中加入一定量的H2C2O4溶液,当溶液中的KMnO4耗尽后,紫色溶液将褪去.为确保能观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4):n(KMnO4)≥2.5.
(2)为探究反应物浓度对化学反应速率的影响,该小组设计了如下实验方案
| 实验序号 | 反应温度/℃ | H2C2O4溶液 | 酸性KMnO4溶液 | H2O | ||
| V/mL | c(mol•L-1) | V/mL | c(mol•L-1) | V/mL | ||
| ① | 25 | 8.0 | 0.20 | 5.0 | 0.010 | 0 |
| ② | 25 | 6.0 | 0.20 | 5.0 | 0.010 | x |
14.下列变化中,属于加成反应的是( )
| A. | 乙烯使酸性KMnO4溶液褪色的反应 | B. | 甲烷与氯气在光照条件下的反应 | ||
| C. | 乙烯使溴水褪色的反应 | D. | 乙烯的燃烧反应 |
11.有乙烯与乙炔的混合气体100mL,与280mL氧气充分反应,完全燃烧后生成二氧化碳的体积(以上气体体积均在相同状况下测定)
| A. | 小于200mL | B. | 200mL | C. | 大于200mL | D. | 无法确定 |
8.从海水中提取溴有如下反应:5NaBr+NaBrO3+3H2SO4═3Br2+Na2SO4+3H2O,与上述反应在氧化还原反应原理上最相似的是( )
| A. | 3Cl2+6NaOH=2NaClO3+5NaCl+3H2O | |
| B. | CaH2+2H2O=Ca(OH)2+2H2↑ | |
| C. | AlCl3+3NaAlO2+6H2O=4Al(OH)3↓+3NaCl | |
| D. | 2CuO+Cu2S=4Cu+SO2↑ |
19.将淀粉加入试管里,加适量的水,振荡,加热煮沸,取所得溶液3mL,加1mL 稀硫酸溶液,加热一分钟,冷却后加入新制的Cu(OH)2悬浊液,加热后未见红色沉淀,其原因是( )
| A. | 加入Cu(OH)2浊液之前,未用NaOH溶液中和硫酸 | |
| B. | 制Cu(OH)2时,硫酸铜溶液太稀,NaOH过量了 | |
| C. | 加热时间不充分,淀粉没有充分水解 | |
| D. | 所用淀粉浓度不够 |
 物质A~G均由短周期元素组成,A、B为非金属气体单质,B原子最外层电子数比次外层电子数的2倍还多1.甲、乙均为金属单质,且甲的原子半径在第三周期最大.各物质间的转化关系如下(部分生成物未给出,且未注明反应条件):
物质A~G均由短周期元素组成,A、B为非金属气体单质,B原子最外层电子数比次外层电子数的2倍还多1.甲、乙均为金属单质,且甲的原子半径在第三周期最大.各物质间的转化关系如下(部分生成物未给出,且未注明反应条件): ;
;