题目内容
4.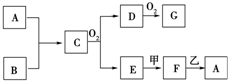 物质A~G均由短周期元素组成,A、B为非金属气体单质,B原子最外层电子数比次外层电子数的2倍还多1.甲、乙均为金属单质,且甲的原子半径在第三周期最大.各物质间的转化关系如下(部分生成物未给出,且未注明反应条件):
物质A~G均由短周期元素组成,A、B为非金属气体单质,B原子最外层电子数比次外层电子数的2倍还多1.甲、乙均为金属单质,且甲的原子半径在第三周期最大.各物质间的转化关系如下(部分生成物未给出,且未注明反应条件):请回答:
(1)物质D的化学式NO;
(2)物质C的电子式是
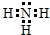 ;
;(3)实验室制取C的化学方程式Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(4)物质F和乙反应生成A的离子方程式2OH-+2Al+2H2O=2AlO2-+3H2↑;
(5)物质C和O2反应生成D和E的化学反应方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
分析 B为短周期非金属气体单质,B原子最外层电子数比次外层电子数的2倍还多1,最外层电子数不超过8,则次外层为K层,所以B原子最外层电子数是5,所以该元素是N元素,则B是N2,A为短周期非金属气体单质,且能和氮气反应生成C,C能被氧气氧化,则A是H2,C是NH3,氨气被氧气氧化生成NO和H2O,D能被氧气氧化,则D是NO,G是NO2,E是H2O,甲、乙均为金属单质,且甲的原子半径在第三周期最大,则甲是Na,钠和水反应生成氢氧化钠和氢气,F能和短周期金属反应,则F是NaOH,乙是Al,结合物质的性质分析解答.
解答 解:B为短周期非金属气体单质,B原子最外层电子数比次外层电子数的2倍还多1,最外层电子数不超过8,则次外层为K层,所以B原子最外层电子数是5,所以该元素是N元素,则B是N2,A为短周期非金属气体单质,且能和氮气反应生成C,C能被氧气氧化,则A是H2,C是NH3,氨气被氧气氧化生成NO和H2O,D能被氧气氧化,则D是NO,G是NO2,E是H2O,甲、乙均为金属单质,且甲的原子半径在第三周期最大,则甲是Na,钠和水反应生成氢氧化钠和氢气,F能和短周期金属反应,则F是NaOH,乙是Al,
(1)通过以上分析知,D是NO,故答案为:NO;
(2)C是氨气,每个氢原子核外有1个电子,每个氮原子最外层5个电子,和三个氢原子形成三个共价键,所以其电子式为: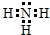 ,
,
故答案为: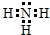 ;
;
(3)C是氨气,实验室采用加热氯化铵和氢氧化钙的方法制取氨气,反应方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(4)F是氢氧化钠,乙是铝,铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,离子反应方程式为2OH-+2Al+2H2O=2AlO2-+3H2↑,
故答案为:2OH-+2Al+2H2O=2AlO2-+3H2↑;
(5)物质C和O2反应生成D和E的反应是氨气的催化氧化,氨气具有还原性,氧气具有氧化性,氨气中氮元素为-3价,被氧气氧化为+2价的氮元素,所以氨气和氧气反应生成一氧化氮和水,反应化学方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
点评 本题考查了无机物的推断,以“B原子结构、甲原子结构、结合物质的状态”为突破口进行推断,明确元素在周期表中的位置、元素周期律、物质的性质是解本题关键,同时考查学生分析问题、解决问题能力,知道氨气的实验室制法,题目难度中等.

| A. | 0.1 nm左右 | B. | 50 nm左右 | C. | 0.001 mm左右 | D. | 100 mm左右 |
| A. | 中子数为20的氯原子:1720Cl | B. | S2-的结构示意图: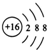 | ||
| C. | 四氯化碳的电子式: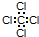 | D. | 乙醇的结构式:C2H6O |
| A. | Na的原子结构示意图: | B. | NaCl的电子式:Na:Cl | ||
| C. | 乙烯的结构式:CH2=CH2 | D. | 乙醇的结构简式:CH3CH2OH |
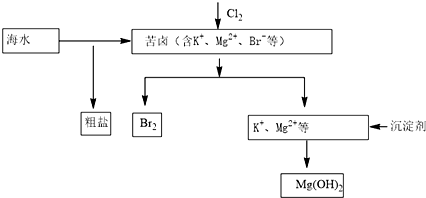
| A. | 工业生产中常选用NaOH作为沉淀剂 | |
| B. | 粗盐可采用溶解、过滤和重结晶等过程进一步提纯 | |
| C. | 向苦卤中通入Cl2是为了提取溴 | |
| D. | 富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收 |
 下列给出了烃及烃的衍生物A、B、C、D、E的相关信息:
下列给出了烃及烃的衍生物A、B、C、D、E的相关信息: .
.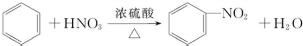

 A、B、C、D、E、F 六种有机物.A能够在光照条件下与氯气发生取代反应,其二氯取代物有两种; B与溴的四氯化碳溶液可以发生加成反应,加成产物是D,且D只有一种同分异构体E;C在FeBr3 的作用下,可以与液溴发生取代反应,取代产物是F,F没有含苯环的同分异构体.根据以上事实,回答下列问题:
A、B、C、D、E、F 六种有机物.A能够在光照条件下与氯气发生取代反应,其二氯取代物有两种; B与溴的四氯化碳溶液可以发生加成反应,加成产物是D,且D只有一种同分异构体E;C在FeBr3 的作用下,可以与液溴发生取代反应,取代产物是F,F没有含苯环的同分异构体.根据以上事实,回答下列问题: ;
;