题目内容
11.有乙烯与乙炔的混合气体100mL,与280mL氧气充分反应,完全燃烧后生成二氧化碳的体积(以上气体体积均在相同状况下测定)| A. | 小于200mL | B. | 200mL | C. | 大于200mL | D. | 无法确定 |
分析 CH2=CH2+3O2$\stackrel{点燃}{→}$2CO2+2H2O、CH≡CH+$\frac{5}{2}$O2$\stackrel{点燃}{→}$2CO2+H2O,则均为乙烯,完全燃烧需要300mL氧气,若均为乙炔,完全燃烧生成250mL气体,结合消耗的氧气判断混合气体的组成,或利用C原子守恒判断生成的二氧化碳,以此来解答.
解答 解:(方法一)设乙烯与乙炔的体积分别为x、y,
由CH2=CH2+3O2$\stackrel{点燃}{→}$2CO2+2H2O、CH≡CH+$\frac{5}{2}$O2$\stackrel{点燃}{→}$2CO2+H2O可知,
$\left\{\begin{array}{l}{x+y=100}\\{3x+2.5y=280}\end{array}\right.$,
解得x=60,y=40,
由C原子守恒可知,生成二氧化碳的体积为60mL×2+40mL×2=200mL,
(方法二)乙烯与乙炔均含2个C原子,由C原子守恒可知完全燃烧后生成二氧化碳的体积100mL×2=200mL,
故选B.
点评 本题考查化学反应方程式的计算,为高频考点,把握发生的反应、原子守恒等为解答的关键,侧重分析与计算能力的考查,注意守恒法的应用,题目难度不大.

练习册系列答案
相关题目
1.下列装置或操作能达到实验目的是( )
| A. |  制备氢氧化亚铁并观察其颜色 | B. |  构成铜锌原电池 | ||
| C. |  检查装置气密性 | D. |  浓硫酸稀释 |
19.下列各项中表达正确的是( )
| A. | Na的原子结构示意图: | B. | NaCl的电子式:Na:Cl | ||
| C. | 乙烯的结构式:CH2=CH2 | D. | 乙醇的结构简式:CH3CH2OH |
3.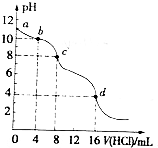 用已知浓度的盐酸滴定未知浓度的Na2CO3溶液.测得混合溶液的pH随所加盐酸体积的变化曲线如图(已知饱和CO2溶液pH为3.9),下列说法正确的是( )
用已知浓度的盐酸滴定未知浓度的Na2CO3溶液.测得混合溶液的pH随所加盐酸体积的变化曲线如图(已知饱和CO2溶液pH为3.9),下列说法正确的是( )
 用已知浓度的盐酸滴定未知浓度的Na2CO3溶液.测得混合溶液的pH随所加盐酸体积的变化曲线如图(已知饱和CO2溶液pH为3.9),下列说法正确的是( )
用已知浓度的盐酸滴定未知浓度的Na2CO3溶液.测得混合溶液的pH随所加盐酸体积的变化曲线如图(已知饱和CO2溶液pH为3.9),下列说法正确的是( )| A. | 该Na2CO3溶液的浓度为0.001mol/L | |
| B. | pH=6时,c(Na+)>c(HCO3-)>c(CO32-) | |
| C. | 在pH=7时,c(Na+)=c(Cl-) | |
| D. | c→d发生的主要离子反应为:CO32-+H+=HCO3- |
10.电解法降解NO3-的原理如图所示,电解总反应为4NO3-+4H+$\frac{\underline{\;通电\;}}{\;}$2N2↑++5O2↑+2H2O.下列说法正确的是( )

| A. | 电子通过盐桥向正极方向移动 | |
| B. | 电源的正极反应式为AsO43-+2H++2e-═AsO33-+H2O | |
| C. | 导线中流过1 mol e-时,理论上有1.2 mol H+通过质子交换膜 | |
| D. | Ag-Pt电极附近溶液的pH减小 |
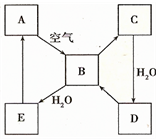 如图表示某淡黄色固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).B和C的相对分子质量相差16,化合物D是重要的工业原料.
如图表示某淡黄色固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).B和C的相对分子质量相差16,化合物D是重要的工业原料.