题目内容
10.下列各项表述中正确的是( )| A. | I-131的原子组成:5378I | B. | HCl电子式: | ||
| C. | Na2S的电子式: | D. | D2O的摩尔质量为:18g/mol |
分析 A.I-131的质量数为131,元素符号的左上角为质量数、左下角为质子数,
B.氯化氢为共价化合物,分子中不存在阴阳离子;
C.硫化钠为离子化合物,阴阳离子需要标出所带电荷,硫离子还需要标出最外层电子;
D.D的相对原子量为4,D2O的摩尔质量为20g/mol.
解答 解:A.I-131的质量数为131,质子数为53,正确的表示方法为:53131I,故A错误;
B.氯化氢属于共价化合物,分子中存在一个H-Cl键,氯原子最外层达到8个电子,氯化氢正确的电子式为 ,故B错误;
,故B错误;
C.Na2S为离子化合物,阴阳离子需要标出所带电荷,其电子式为 ,故C正确;
,故C正确;
D.D2O的相对分子质量为20,其摩尔质量为20g/mol,故D错误;
故选C.
点评 本题考查了常见化学用语的表示方法,题目难度不大,涉及电子式、元素符号、摩尔质量等知识,明确常见化学用语的概念及书写原则为解答关键,试题侧重考查学生的规范答题能力.

练习册系列答案
相关题目
20.NA为阿伏加德罗常数值,下列说法中正确的是( )
| A. | 标准状况下,11.2L四氯化碳所含分子数为0.5NA | |
| B. | 1L1mol/l的盐酸溶液中,所含氯化氢分子数为NA | |
| C. | 标准状况下,0.5molCO2所占的体积约为11.2L | |
| D. | 11.2L氧气所含的原子数为NA |
1.下列装置或操作能达到实验目的是( )
| A. |  制备氢氧化亚铁并观察其颜色 | B. |  构成铜锌原电池 | ||
| C. |  检查装置气密性 | D. |  浓硫酸稀释 |
18.工业上最初获得苯的主要方法是( )
| A. | 石油的分馏 | B. | 石油的裂解 | C. | 煤的干馏 | D. | 煤的液化 |
5.设NA 表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,0.1 mol Cl2被氢氧化钠溶液完全吸收,转移的电子数目为0.2NA | |
| B. | 标准状况下,11.2 L CH3OH中含有的共价键数目为2.5NA | |
| C. | 常温常压下,2.24 L CO和CO2混合气体中含有的碳原子数目为0.1NA | |
| D. | 常温常压下,16 g CH4中含有的原子总数为5NA |
15.下列化学用语正确的是( )
| A. | 中子数为20的氯原子:1720Cl | B. | S2-的结构示意图: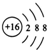 | ||
| C. | 四氯化碳的电子式: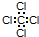 | D. | 乙醇的结构式:C2H6O |
19.下列各项中表达正确的是( )
| A. | Na的原子结构示意图: | B. | NaCl的电子式:Na:Cl | ||
| C. | 乙烯的结构式:CH2=CH2 | D. | 乙醇的结构简式:CH3CH2OH |
10.电解法降解NO3-的原理如图所示,电解总反应为4NO3-+4H+$\frac{\underline{\;通电\;}}{\;}$2N2↑++5O2↑+2H2O.下列说法正确的是( )

| A. | 电子通过盐桥向正极方向移动 | |
| B. | 电源的正极反应式为AsO43-+2H++2e-═AsO33-+H2O | |
| C. | 导线中流过1 mol e-时,理论上有1.2 mol H+通过质子交换膜 | |
| D. | Ag-Pt电极附近溶液的pH减小 |