题目内容
8.从海水中提取溴有如下反应:5NaBr+NaBrO3+3H2SO4═3Br2+Na2SO4+3H2O,与上述反应在氧化还原反应原理上最相似的是( )| A. | 3Cl2+6NaOH=2NaClO3+5NaCl+3H2O | |
| B. | CaH2+2H2O=Ca(OH)2+2H2↑ | |
| C. | AlCl3+3NaAlO2+6H2O=4Al(OH)3↓+3NaCl | |
| D. | 2CuO+Cu2S=4Cu+SO2↑ |
分析 5NaBr+NaBrO3+3H2SO4═3Br2+Na2SO4+3H2O中只有Br元素的化合价变化,为归中反应,以此来解答.
解答 解:A.只有Cl元素的化合价变化,为歧化反应,故A不选;
B.只有H元素的化合价变化,为归中反应,故B选;
C.无元素的化合价变化,故C不选;
D.Cu、S元素的化合价均发生变化,故D不选;
故选B.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意常见元素化合价判断,题目难度不大.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
18.工业上最初获得苯的主要方法是( )
| A. | 石油的分馏 | B. | 石油的裂解 | C. | 煤的干馏 | D. | 煤的液化 |
19.下列各项中表达正确的是( )
| A. | Na的原子结构示意图: | B. | NaCl的电子式:Na:Cl | ||
| C. | 乙烯的结构式:CH2=CH2 | D. | 乙醇的结构简式:CH3CH2OH |
3.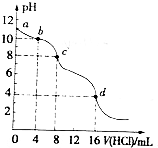 用已知浓度的盐酸滴定未知浓度的Na2CO3溶液.测得混合溶液的pH随所加盐酸体积的变化曲线如图(已知饱和CO2溶液pH为3.9),下列说法正确的是( )
用已知浓度的盐酸滴定未知浓度的Na2CO3溶液.测得混合溶液的pH随所加盐酸体积的变化曲线如图(已知饱和CO2溶液pH为3.9),下列说法正确的是( )
 用已知浓度的盐酸滴定未知浓度的Na2CO3溶液.测得混合溶液的pH随所加盐酸体积的变化曲线如图(已知饱和CO2溶液pH为3.9),下列说法正确的是( )
用已知浓度的盐酸滴定未知浓度的Na2CO3溶液.测得混合溶液的pH随所加盐酸体积的变化曲线如图(已知饱和CO2溶液pH为3.9),下列说法正确的是( )| A. | 该Na2CO3溶液的浓度为0.001mol/L | |
| B. | pH=6时,c(Na+)>c(HCO3-)>c(CO32-) | |
| C. | 在pH=7时,c(Na+)=c(Cl-) | |
| D. | c→d发生的主要离子反应为:CO32-+H+=HCO3- |
10.电解法降解NO3-的原理如图所示,电解总反应为4NO3-+4H+$\frac{\underline{\;通电\;}}{\;}$2N2↑++5O2↑+2H2O.下列说法正确的是( )

| A. | 电子通过盐桥向正极方向移动 | |
| B. | 电源的正极反应式为AsO43-+2H++2e-═AsO33-+H2O | |
| C. | 导线中流过1 mol e-时,理论上有1.2 mol H+通过质子交换膜 | |
| D. | Ag-Pt电极附近溶液的pH减小 |
7.下列贮存化学试剂的方法正确的是( )
| A. | 新制的氯水保存在棕色广口瓶中,并放在阴凉处 | |
| B. | 波尔多液(CuSO4与石灰水按一定比例混合)盛放在铁制容器中 | |
| C. | 烧碱溶液放在带玻璃塞的磨口试剂瓶中 | |
| D. | 金属钠保存在煤油中 |
8.在指定环境中,下列各组离子可以大量共存的是( )
| A. | 加入铝片立即放出氢气的溶液中:C1-、K+、NH4+、NO3- | |
| B. | 滴加石蕊试液呈红色的溶液中:CO32-、K+、ClO-、OH- | |
| C. | pH=13的溶液中:HCO3-、Na+、NO3-、SO42 | |
| D. | 在pH=3的溶液中:NH4+、Ca2+、C1-、K+ |
 A、B、C、D、E、F 六种有机物.A能够在光照条件下与氯气发生取代反应,其二氯取代物有两种; B与溴的四氯化碳溶液可以发生加成反应,加成产物是D,且D只有一种同分异构体E;C在FeBr3 的作用下,可以与液溴发生取代反应,取代产物是F,F没有含苯环的同分异构体.根据以上事实,回答下列问题:
A、B、C、D、E、F 六种有机物.A能够在光照条件下与氯气发生取代反应,其二氯取代物有两种; B与溴的四氯化碳溶液可以发生加成反应,加成产物是D,且D只有一种同分异构体E;C在FeBr3 的作用下,可以与液溴发生取代反应,取代产物是F,F没有含苯环的同分异构体.根据以上事实,回答下列问题: ;
;