题目内容
15.下列说法正确的是( )| A. | 由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定 | |
| B. | 500℃、30M Pa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ/mol | |
| C. | 已知热化学方程式:2SO2(g)+O2?(g) 2SO3(g)△H=-Q kJ/mol,若将一定量的SO2(g)和O2(g)置于密闭容器中充分反应后放出热量Q kJ,则此过程中有2 mol SO2(g)被氧化 | |
| D. | X(g)+Y(g)?Z(g)△H>0,恒温恒容条件下达到平衡后加入X,上述反应△H增大 |
分析 A.根据反应热可判断反应物和生成物的能量高低,以此判断稳定性;
B.0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,生成的氨气的物质的量小于1mol,相同条件下的同一可逆反应,正逆反应反应热数值相等,符号相反;
C.反应后放出热量Q kJ,则右2mol二氧化硫参与反应;
D.焓变与化学方程式的书写有关,与加入反应物多少无关.
解答 解:A.由单质A转化为单质B是一个吸热过程,说明A的能量小于B,则单质B不如A稳定,故A错误;
B.相同条件下的同一可逆反应,正逆反应反应热数值相等,符号相反,0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,生成的氨气的物质的量小于1mol,所以2mol氨气分解,吸收的热量大于38.6kJ,故B错误;
C.若将一定量SO2(g)和O2(g)置于某密闭容器中充分反应后放热QkJ,参加反应的二氧化硫为2mol,故一定有2molSO2(g)被氧化,故C正确;
D.由于焓变由化学方程式中的化学计量数决定,与加入反应物多少无关,则恒温恒容条件下达到平衡后加入X,该反应的△H不变,故D错误;
故选C.
点评 本题考查反应热与焓变的应用,题目难度中等,明确可逆反应特点为解答关键,注意掌握化学反应与能量变化的关系,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案
相关题目
6.下列有机实验操作或叙述正确的是( )
| A. | 将乙烯和乙炔气体分别通入溴的四氯化碳溶液中,两者都褪色 | |
| B. | 甲烷和氯气在室温下的光照环境中可以稳定存在 | |
| C. | 苯能使溴水褪色是因为二者反应生成了溴苯 | |
| D. | 要除去乙烷中的乙烯制得纯净的乙烷,将混合气体通入酸性高锰酸钾溶液中 |
3.如图所示,φ(X)为气态反应物在平衡混合物中的体积分数,T为温度.符合该曲线的反应是( )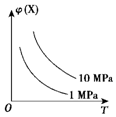

| A. | N2(g)+3H2(g)?2NH3(g)△H<0 | B. | 2HI(g)?H2(g)+I2(g)△H>0 | ||
| C. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0 | D. | C(s)+H2O(g)?H2(g)+CO(g)△H>0 |
20.在焊接铜器时,可用NH4Cl溶液除去铜器表面的氧化铜,其反应为CuO+NH4Cl-Cu+CuCl2+N2↑+H2O(未配平).下列有关该反应的说法正确的是( )
| A. | 参加反应的氧化剂和还原剂的物质的量之比为3:2 | |
| B. | 被氧化和被还原的元素分别为铜和氮 | |
| C. | 当产生0.2 mol气体时,转移电子为0.6 mol | |
| D. | 被还原的CuO占参与反应CuO的$\frac{1}{2}$ |
4.氢镍电池是近年开发出来的可充电电池,它可以取代会产生污染的铜镍电池.氢镍电池的总反应式是
$\frac{1}{2}$H2+NiO(OH)$?_{放电}^{充电}$Ni(OH)2.根据此反应判断,下列叙述中正确的是( )
$\frac{1}{2}$H2+NiO(OH)$?_{放电}^{充电}$Ni(OH)2.根据此反应判断,下列叙述中正确的是( )
| A. | 电池放电时,电池负极周围溶液的c(OH-)为断增大 | |
| B. | 电池放电时,H2是负极 | |
| C. | 电池放时时,氢元素被氧化 | |
| D. | 电池放电时,镍元素被氧化 |
5.碳纳米管新型二次电池的装置示意图如下图,下列相关说法不正确的是( )
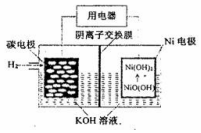

| A. | 放电时,OH-向碳电极迁移 | |
| B. | 放电时,负极反应NiO(OH)+H2O+e-=Ni(OH)2+OH- | |
| C. | 充电时,镍电极与电极的正极相连 | |
| D. | 充电时,碳电极区溶液pH增大 |
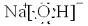 ,构成C单质的元素在周期表中位于第三周期第VIIA族
,构成C单质的元素在周期表中位于第三周期第VIIA族