题目内容
9.设NA为阿伏伽德罗常数的值.下列说法正确的是( )| A. | 将1molCl2通入水中,HClO、Cl-、ClO-粒子数之和为2NA | |
| B. | 12gNaHSO4固体中含阳离子数为0.1NA | |
| C. | 标准状况下,22.4LBr2中所含分子数为NA | |
| D. | 7.8gNa2O2与足量的水反应转移电子数为0.2NA |
分析 A、氯气和水的反应为可逆反应;
B、求出硫酸氢钠固体的物质的量,然后根据硫酸氢钠固体由钠离子和硫酸氢根离子构成;
C、标况下溴为液体;
D、求出过氧化钠的物质的量,然后根据过氧化钠和水反应时1mol过氧化钠转移1mol电子来分析.
解答 解:A、氯气和水的反应为可逆反应,不能进行彻底,故氯水中含未反应的氯气分子,即溶液中的HClO、Cl-、ClO-粒子数之和小于2NA,故A错误;
B、12g硫酸氢钠固体的物质的量为0.1mol,而硫酸氢钠固体由钠离子和硫酸氢根离子构成,故0.1mol硫酸氢钠固体中含0.1NA个阳离子,故B正确;
C、标况下溴为液体,故不能根据气体摩尔体积来计算其物质的量,故C错误;
D、7.8g过氧化钠的物质的量为0.1mol,而过氧化钠和水反应时1mol过氧化钠转移1mol电子,故0.1mol过氧化钠转移0.1NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
相关题目
19.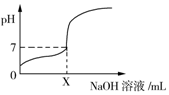 常温下,用0.1mol/L的NaOH溶液滴定20mL同浓度的一元弱酸HA,滴定过程中溶液pH随NaOH溶液体积变化曲线如图所示(忽略中和热效应),下列说法正确的是( )
常温下,用0.1mol/L的NaOH溶液滴定20mL同浓度的一元弱酸HA,滴定过程中溶液pH随NaOH溶液体积变化曲线如图所示(忽略中和热效应),下列说法正确的是( )
 常温下,用0.1mol/L的NaOH溶液滴定20mL同浓度的一元弱酸HA,滴定过程中溶液pH随NaOH溶液体积变化曲线如图所示(忽略中和热效应),下列说法正确的是( )
常温下,用0.1mol/L的NaOH溶液滴定20mL同浓度的一元弱酸HA,滴定过程中溶液pH随NaOH溶液体积变化曲线如图所示(忽略中和热效应),下列说法正确的是( )| A. | X=20 | |
| B. | HA溶液加水稀释后,溶液中$\frac{c(HA)}{{c({A^-})}}$的值减小 | |
| C. | 0.1 mol/L的NaOH溶液中,由水电离出的c(OH-)=0.1 mol/L | |
| D. | 加入NaOH溶液体积为X mL时,溶液中c(A-)=0.05 mol/L |
17.下列反应所得到的有机产物不属于纯净物的是( )
| A. | 2-氯丁烷与氢氧化钠、乙醇在加热条件下的消去反应 | |
| B. | 乙烯通入溴水中的加成反应 | |
| C. | 灼热的铜丝插入足量乙醇中的氧化反应 | |
| D. | 苯酚与足量的氢气在一定条件下的加成反应 |
4.化学与生活、社会发展息息相关,下列说法正确的是( )
| A. | 加热能杀死流感病毒是因为蛋白质受热变性 | |
| B. | 用乙醚从黄花蒿中提取青蒿素是利用了氧化还原反应原理 | |
| C. | “丹砂(HgS)烧之成水银,积变又成丹砂.”这个过程是可逆反应 | |
| D. | 丁达尔效应可用于区别溶液与胶体,云、雾、稀硫酸均能产生丁达尔效应 |
14.下列变化过程不涉及化学反应的是( )
| A. | 陶瓷的烧制 | B. | 活字印刷排版术 | ||
| C. | 鞭炮和烟花的燃放 | D. | 司母戊鼎表面出现铜绿 |
1.下列说法错误的是( )
| A. | 甲烷分子是正四面体结构 | B. | 丙炔分子中的碳原子在同一直线上 | ||
| C. | 有机分子中碳原子均形成四个价键 | D. | 二氟甲烷的有2种同分异构体 |
18.常温下,下列反应产生氢气最多的是( )
| A. | 1.12 g铁与足量浓硫酸反应 | |
| B. | 0.12g镁与足量盐酸反应 | |
| C. | 0.02mol钠与足量水反应 | |
| D. | 0.01mol铝与足量氢氧化钠溶液反应 |
17.一定温度下,某容器中加入足量的碳酸钙,发生反应CaCO3(s)?CaO(s)+CO2(g)达到平衡.下列说法正确的是( )
| A. | 将体积缩小为原来的一半,当体系再次达到平衡时,CO2的浓度为原来的2倍 | |
| B. | CaCO3(s)加热分解成CaO(s)和CO2(g),△S<0 | |
| C. | 将体积增大为原来的2倍,再次达到平衡时,平衡向正方向移动 | |
| D. | 保持容器体积不变,充入He,平衡向逆反应方向进行 |


 ;
; ;
; .
.