题目内容
17.下列反应所得到的有机产物不属于纯净物的是( )| A. | 2-氯丁烷与氢氧化钠、乙醇在加热条件下的消去反应 | |
| B. | 乙烯通入溴水中的加成反应 | |
| C. | 灼热的铜丝插入足量乙醇中的氧化反应 | |
| D. | 苯酚与足量的氢气在一定条件下的加成反应 |
分析 A.CH3CH2CCl(CH3)2在NaOH醇溶液受热发生消去反应可生成CH3CH2C=C(CH3)2或CH3CH2C(CH3)=CH2;
B.乙烯通入溴水中生成1,2-二溴乙烷;
C.灼热的铜丝插入足量乙醇中的氧化反应生成乙醛;
D.苯酚与足量的氢气在一定条件下的加成反应可生成环己醇.
解答 解:A.CH3CH2CCl(CH3)2在NaOH醇溶液受热发生消去反应可生成CH3CH2C=C(CH3)2或CH3CH2C(CH3)=CH2,不能得到纯净物,故A选;
B.乙烯通入溴水中生成1,2-二溴乙烷,只有一种产物,故B不选;
C.灼热的铜丝插入足量乙醇中的氧化反应生成乙醛,有机产物只有一种,故C不选;
D.苯酚与足量的氢气在一定条件下的加成反应可生成环己醇,产物只有一种,故D不选.
故选A.
点评 本题考查有机物的结构和性质,为高考常见题型,侧重于物质的性质,反应类型以及同分异构体的判断,难度不大,注意把握有机物的官能团的性质与结构的关系.

练习册系列答案
 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
7.当电解质溶液为氢氧化钾水溶液的氢氧燃料电池电解饱和碳酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法正确的是( )
| A. | 当电池负极消耗mg气体时,电解池阳极同时有mg气体生成 | |
| B. | 电池的正极反应式为:4OH--4e-=O2↑+2H2O | |
| C. | 电解后c(Na2CO3)不变,且溶液中有晶体析出 | |
| D. | 电池中c(KOH)不变;电解池中溶液pH变大 |
8.某化学兴趣小组要完成中和热的测定.回答下列问题:
实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5mol•L-1盐酸、0.55mol•L-1NaOH溶液,实验尚缺少的玻璃用品是量筒、温度计.
(2)已知:反应后溶液的比热容c为4.18J•℃-1•g-1,0.5mol•L-1盐酸和0.55mol•L-1NaOH溶液的密度均为1g•c
m-3.实验时记录的实验数据如表:
①盐酸和氢氧化钠反应的中和热△H1=-56.8kJ•mol-1(保留两位小数)
②已知:CH3COOH(aq)?CH3COO-(aq)+H+(aq)△H2>0,
CH3COOH(aq)+OH-(aq)=CH3COO-(aq)+H20(l)△H3 则△H3>△H1(填“>”、“<”、“=”)
实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5mol•L-1盐酸、0.55mol•L-1NaOH溶液,实验尚缺少的玻璃用品是量筒、温度计.
(2)已知:反应后溶液的比热容c为4.18J•℃-1•g-1,0.5mol•L-1盐酸和0.55mol•L-1NaOH溶液的密度均为1g•c
m-3.实验时记录的实验数据如表:
| 实验 次数 | 反应物及用量 | 溶 液 温 度 | ||
| t1 | t2 | |||
| 1 | 50mL0.55mol•L-1NaOH溶液 | 50mL.0.5mol•L-1HCl溶液 | 20℃ | 23.3℃ |
| 2 | 50mL0.55mol•L-1NaOH溶液 | 50mL.0.5mol•L-1HCl溶液 | 20℃ | 23.5℃ |
②已知:CH3COOH(aq)?CH3COO-(aq)+H+(aq)△H2>0,
CH3COOH(aq)+OH-(aq)=CH3COO-(aq)+H20(l)△H3 则△H3>△H1(填“>”、“<”、“=”)
5.电离平衡是溶液化学中的重要内容,某化学兴趣小组拟以乙酸为例探究弱酸的性质.
(1)实验一:氢氧化钠标准溶液的配制.
现要配制0.1000mol/LNaOH标准溶液250mL,需要用到的玻璃仪器有玻璃棒、烧杯、胶头滴管和250毫升容量瓶,操作过程中如果没有将烧杯等的洗涤液一并转入容量瓶,在其它操作都正确的情况下,将该标准溶液用来滴定下列(2)中的未知浓度的乙酸溶液,将会使侧定的结果偏高(填“高”、“低”、“不影响”)
(2)实验二:现有一瓶乙酸溶液,常温下测定其中乙酸的电离平衡常数.设计实验方案,将待测物理量和对应的测定方法填写在表一中.
表一:
③上述实验中,如果在某温度时测得乙酸溶液的物质的量浓度为0.1000mol/L,pH=3,则在该温度时乙酸的电离平衡常数为1×10-5.
(3)实验三:探究酸的强弱对酸与镁条反应速率的影响.
①设计实验方案如表二,表二中c=2.0g.
表二:
②实验步骤:
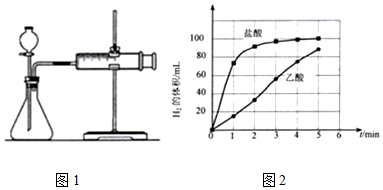
a)图1的装置中,在添加药品之前必须检查装置的气密性;
b)反应开始后,每隔1min记录一次生成H2的体积;
c)将所记录的欲据绘制成曲线图(图2).
③写出镁与乙酸溶液反应的离子方程式:Mg+2CH3COOH=Mg2++2CH3COO-+H2↑.
④描述0~5min盐酸与镁条反应的反应速率变化规律:醋酸与镁条反应的速率随时间变化不明显,盐酸与镁条反应开始阶段反应速率很快,一段时间后反应速率明显减小.
(1)实验一:氢氧化钠标准溶液的配制.
现要配制0.1000mol/LNaOH标准溶液250mL,需要用到的玻璃仪器有玻璃棒、烧杯、胶头滴管和250毫升容量瓶,操作过程中如果没有将烧杯等的洗涤液一并转入容量瓶,在其它操作都正确的情况下,将该标准溶液用来滴定下列(2)中的未知浓度的乙酸溶液,将会使侧定的结果偏高(填“高”、“低”、“不影响”)
(2)实验二:现有一瓶乙酸溶液,常温下测定其中乙酸的电离平衡常数.设计实验方案,将待测物理量和对应的测定方法填写在表一中.
表一:
| 待测物理量 | 测定方法 |
| ①乙酸溶液的物质的量浓度 | 量取25.00mL乙酸溶液于锥形瓶中,滴加指示剂,将0.1000mol/LNaOH标准溶液装入碱式滴定管,滴定至终点,记录数据.重复滴定2次. |
| ②H+的物质的量浓度 | 取适最乙酸溶液于烧杯中,用pH计或精密pH试纸测定溶液pH. |
(3)实验三:探究酸的强弱对酸与镁条反应速率的影响.
①设计实验方案如表二,表二中c=2.0g.
表二:
| 编号 | 酸的种类 | 酸的浓度(mol/L) | 酸的体积/mL | 镁条质量/g |
| l | 乙酸 | 0.5 | 17.0 | 2.0 |
| 2 | 盐酸 | 0.5 | 17.0 | c |

a)图1的装置中,在添加药品之前必须检查装置的气密性;
b)反应开始后,每隔1min记录一次生成H2的体积;
c)将所记录的欲据绘制成曲线图(图2).
③写出镁与乙酸溶液反应的离子方程式:Mg+2CH3COOH=Mg2++2CH3COO-+H2↑.
④描述0~5min盐酸与镁条反应的反应速率变化规律:醋酸与镁条反应的速率随时间变化不明显,盐酸与镁条反应开始阶段反应速率很快,一段时间后反应速率明显减小.
12.下列烷烃分子中去掉一个氢原子后所得的烃基最多的是( )
| A. | 甲烷 | B. | 乙烷 | C. | 丙烷 | D. | 丁烷 |
9.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 将1molCl2通入水中,HClO、Cl-、ClO-粒子数之和为2NA | |
| B. | 12gNaHSO4固体中含阳离子数为0.1NA | |
| C. | 标准状况下,22.4LBr2中所含分子数为NA | |
| D. | 7.8gNa2O2与足量的水反应转移电子数为0.2NA |
6.生活处处有化学,下列说法不正确的是( )
| A. | 明矾可作净水剂 | |
| B. | 生石灰用于食品抗氧化剂 | |
| C. | 用热碱水清除炊具上残留的油污 | |
| D. | 用浸泡过高锰酸钾溶液的硅藻土保存水果 |
5.在一个密闭容器中发生反应:2SO2(g)+O2(g)?2SO3(g).已知反应过程中的某一时间SO2、O2和SO3的浓度分别为:0.2mol/L、0.1mol/L和0.2mol/L.当反应达到平衡时可能存在的数据正确的是( )
| A. | c(O2)=0.2 mol/L | B. | c(SO2)=0.25 mol/L | ||
| C. | c(SO2)+c(SO3)=0.3 mol/L | D. | c(SO2)=c(SO3)=0.15 mol/L |