题目内容
14.下列变化过程不涉及化学反应的是( )| A. | 陶瓷的烧制 | B. | 活字印刷排版术 | ||
| C. | 鞭炮和烟花的燃放 | D. | 司母戊鼎表面出现铜绿 |
分析 判断一个变化是物理变化还是化学变化,要依据在变化过程中有没有生成其他物质,生成其他物质的是化学变化,没有生成其他物质的是物理变化.
解答 解:A.陶瓷制作过程中黏土加热生成硅酸盐,有新物质生成,涉及化学变化,故A错误;
B.活字印刷排版术过程中无新物质生成,属于物理变化,故B正确;
C.鞭炮和烟花的燃放,火药燃烧生成新的物质二氧化碳等气体为化学变化,故C错误;
D.司母戊鼎表面出现铜绿是铜和去、二氧化碳、水蒸气反应生成碱式碳酸铜,有新物质生成为化学变化,故D错误;
故选B.
点评 本题考查物理变化与化学变化的区别与联系,涉及化学反应与生活、生产的考查,为高频考点,侧重于学生的分析能力的考查,有利于培养学生良好的科学素养,提高学习的积极性,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.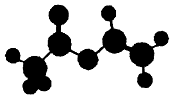 法国、美国、荷兰的三位科学家因研宄“分子机器的设计与合成”获得2016年诺贝尔化学奖.轮烷是一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列说法正确的是( )
法国、美国、荷兰的三位科学家因研宄“分子机器的设计与合成”获得2016年诺贝尔化学奖.轮烷是一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列说法正确的是( )
 法国、美国、荷兰的三位科学家因研宄“分子机器的设计与合成”获得2016年诺贝尔化学奖.轮烷是一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列说法正确的是( )
法国、美国、荷兰的三位科学家因研宄“分子机器的设计与合成”获得2016年诺贝尔化学奖.轮烷是一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列说法正确的是( )| A. | 该化合物的名称为乙酸乙酯 | |
| B. | 该化合物与Br2的四氯化碳溶液不反应 | |
| C. | 该化合物既能发生水解反应,又能发生氧化反应 | |
| D. | 该化合物的同分异构体中,能与NaHCO3反应放出CO2的只有2种 |
5.电离平衡是溶液化学中的重要内容,某化学兴趣小组拟以乙酸为例探究弱酸的性质.
(1)实验一:氢氧化钠标准溶液的配制.
现要配制0.1000mol/LNaOH标准溶液250mL,需要用到的玻璃仪器有玻璃棒、烧杯、胶头滴管和250毫升容量瓶,操作过程中如果没有将烧杯等的洗涤液一并转入容量瓶,在其它操作都正确的情况下,将该标准溶液用来滴定下列(2)中的未知浓度的乙酸溶液,将会使侧定的结果偏高(填“高”、“低”、“不影响”)
(2)实验二:现有一瓶乙酸溶液,常温下测定其中乙酸的电离平衡常数.设计实验方案,将待测物理量和对应的测定方法填写在表一中.
表一:
③上述实验中,如果在某温度时测得乙酸溶液的物质的量浓度为0.1000mol/L,pH=3,则在该温度时乙酸的电离平衡常数为1×10-5.
(3)实验三:探究酸的强弱对酸与镁条反应速率的影响.
①设计实验方案如表二,表二中c=2.0g.
表二:
②实验步骤:
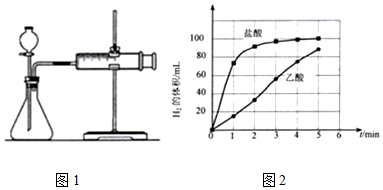
a)图1的装置中,在添加药品之前必须检查装置的气密性;
b)反应开始后,每隔1min记录一次生成H2的体积;
c)将所记录的欲据绘制成曲线图(图2).
③写出镁与乙酸溶液反应的离子方程式:Mg+2CH3COOH=Mg2++2CH3COO-+H2↑.
④描述0~5min盐酸与镁条反应的反应速率变化规律:醋酸与镁条反应的速率随时间变化不明显,盐酸与镁条反应开始阶段反应速率很快,一段时间后反应速率明显减小.
(1)实验一:氢氧化钠标准溶液的配制.
现要配制0.1000mol/LNaOH标准溶液250mL,需要用到的玻璃仪器有玻璃棒、烧杯、胶头滴管和250毫升容量瓶,操作过程中如果没有将烧杯等的洗涤液一并转入容量瓶,在其它操作都正确的情况下,将该标准溶液用来滴定下列(2)中的未知浓度的乙酸溶液,将会使侧定的结果偏高(填“高”、“低”、“不影响”)
(2)实验二:现有一瓶乙酸溶液,常温下测定其中乙酸的电离平衡常数.设计实验方案,将待测物理量和对应的测定方法填写在表一中.
表一:
| 待测物理量 | 测定方法 |
| ①乙酸溶液的物质的量浓度 | 量取25.00mL乙酸溶液于锥形瓶中,滴加指示剂,将0.1000mol/LNaOH标准溶液装入碱式滴定管,滴定至终点,记录数据.重复滴定2次. |
| ②H+的物质的量浓度 | 取适最乙酸溶液于烧杯中,用pH计或精密pH试纸测定溶液pH. |
(3)实验三:探究酸的强弱对酸与镁条反应速率的影响.
①设计实验方案如表二,表二中c=2.0g.
表二:
| 编号 | 酸的种类 | 酸的浓度(mol/L) | 酸的体积/mL | 镁条质量/g |
| l | 乙酸 | 0.5 | 17.0 | 2.0 |
| 2 | 盐酸 | 0.5 | 17.0 | c |

a)图1的装置中,在添加药品之前必须检查装置的气密性;
b)反应开始后,每隔1min记录一次生成H2的体积;
c)将所记录的欲据绘制成曲线图(图2).
③写出镁与乙酸溶液反应的离子方程式:Mg+2CH3COOH=Mg2++2CH3COO-+H2↑.
④描述0~5min盐酸与镁条反应的反应速率变化规律:醋酸与镁条反应的速率随时间变化不明显,盐酸与镁条反应开始阶段反应速率很快,一段时间后反应速率明显减小.
9.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 将1molCl2通入水中,HClO、Cl-、ClO-粒子数之和为2NA | |
| B. | 12gNaHSO4固体中含阳离子数为0.1NA | |
| C. | 标准状况下,22.4LBr2中所含分子数为NA | |
| D. | 7.8gNa2O2与足量的水反应转移电子数为0.2NA |
19.常温时,向一定量的硫酸铜溶液中滴加pH=11 的氨水,当Cu2+完全沉淀时,消耗氨水的体积为V,下列说法正确的是(已知Ksp[Cu(OH)2]=2.2×10-20)( )
| A. | 若将氨水加水稀释,则稀释过程中,$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$始终保持增大 | |
| B. | 滴加过程中,当溶液中c(Cu2+)=2.2×10-2mol/L 时,溶液的pH=9 | |
| C. | 滴加过程中,当溶液的pH=7 时,溶液中2c(NH4+)=c(SO42-) | |
| D. | 若滴加pH=11 的NaOH 溶液,Cu2+完全沉淀时消耗溶液的体积小于V |
6.生活处处有化学,下列说法不正确的是( )
| A. | 明矾可作净水剂 | |
| B. | 生石灰用于食品抗氧化剂 | |
| C. | 用热碱水清除炊具上残留的油污 | |
| D. | 用浸泡过高锰酸钾溶液的硅藻土保存水果 |
3.1mol H2分子和1mol N2分子一定具有相同的( )
| A. | 电子数 | B. | 原子数 | C. | 质子数 | D. | 体积 |
2.下列各组有机物只用一种试剂无法鉴别的是( )
| A. | 乙醇、苯酚、硝基苯 | B. | 苯、乙醛、乙烯 | ||
| C. | 甲酸、甲苯、乙酸 | D. | 苯乙烯、乙苯、环己烷 |